题目内容
17. 氯元素是生产生活中常见的非金属元素
氯元素是生产生活中常见的非金属元素(1)将Cl2通入NaOH溶液中得到以NaClO为有效成分的漂白液,写出该反应的离子方程式:Cl2+2OH-=ClO-+Cl-+H2O.
(2)使用Cl2为自来水消毒时,会与水中的有机物生成对人体有害的有机氯化物.下列物质中可以替代Cl2为自来水杀菌消毒的是ad(填字母序号).
a.臭氧 b.NH3 c.明矾 d.ClO2
(3)生物质混煤燃烧是当今能源燃烧利用的最佳方式之一,但生物质中氯含量较多,燃烧过程中会形成金属氯化物(如NaCl)和Cl2等物质,对金属炉壁造成腐蚀.
①NaCl和Cl2中化学键的类型分别是离子键 和共价键.
②燃煤过程中生成的SO2会与NaCl等物质发生反应,生成硫酸盐和Cl2.若生成Cl2 22.4L(标况)时转移电子数为4×6.02×1023,该反应的化学方程式是2NaCl+SO2+O2$\frac{\underline{\;\;△\;\;}}{\;}$Na2SO4+Cl2.
③已知:
2H2O2(l)═2H2O(l)+O2(g)△H1=-196.46kJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H2=-285.84kJ•mol-1
Cl2(g)+H2(g)═2HCl(g)△H3=-184.60kJ•mol-1
在催化剂作用下,用H2O2(l)可除去上述燃烧过程中产生的Cl2.依据上述已知反应,写出该反应的热化学方程式:H2O2(l)+Cl2(g)=2HCl(g)+O2(g)△H=+3.01 kJ/mol.
(4)工业上通过如下转化可制得KClO3晶体:NaCl溶液$→_{Ⅰ}^{80℃,通电}$NaClO3溶液$→_{Ⅱ}^{室温,KCl}$KClO3晶体,完成Ⅰ中电解过程中阳极的反应式:Cl--6e-+3H2O═ClO-3+6H+.
(5)一定条件下,在水溶液中1mol Cl-、ClOx-(x=1,2,3,4)的能量(kJ)相对大小如图所示.
①D是ClO4-(填离子符号).
②B→A+C反应的热化学方程式为3ClO-(aq)═ClO3-(aq)+2Cl-(aq)△H=-117kJ•mol-1(用离子符号表示).
分析 (1)Cl2通入NaOH溶液,反应生成NaClO、NaCl和水;
(2))替代Cl2为自来水杀菌消毒的物质应具有强氧化性;
(3)①NaCl属于离子化合物,含有离子键,Cl2中氯原子之间形成共价键;
②由题目信息可知,SO2与NaCl等物质生成硫酸钠和Cl2,根据S、O原子比例关系可知,应有氧气参与反应,配平书写化学方程式;
③发生反应:H2O2(l)+Cl2(g)=2HCl(g)+O2(g),
已知①2H2O2(l)═2H2O(l)+O2(g)△H1=-196.46kJ•mol-1
②H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H2=-285.84kJ•mol-1
③Cl2(g)+H2(g)═2HCl(g)△H3=-184.60kJ•mol-1
根据盖斯定律,①×$\frac{1}{2}$+③-②可得:H2O2(l)+Cl2(g)=2HCl(g)+O2(g),反应热也进行相应的计算,进而书写热化学方程式;
(4)Ⅰ中电解过程中阳极上Cl失去电子;
(5)一定条件下,在水溶液1 mol Cl-、ClOx-(x=1,2,3,4,)的能量(kJ)相对大小如图所示.
①D中Cl元素化合价为+7价,据此判断x值;
②B→A+C,根据转移电子守恒得该反应方程式为3ClO-=ClO3-+2Cl-,反应热=(63kJ/mol+2×0kJ/mol)-3×60kJ/mol=-117kJ/mol.
解答 解:(1)氯气与氢氧化钠反应生成氯化钠、次氯酸与水,反应离子方程式为Cl2+2OH-=ClO-+Cl-+H2O,故答案为:Cl2+2OH-=ClO-+Cl-+H2O;
(2)替代Cl2为自来水杀菌消毒的物质应具有强氧化性,可以用臭氧、ClO2代替,氨气不能杀菌消毒、硫酸铝可以除去悬浮物质,不能杀菌消毒,故答案为:ad;
(3)①NaCl属于离子化合物,含有离子键,Cl2中氯原子之间形成共价键,故答案为:离子键;共价键;
②由题目信息可知,SO2与NaCl等物质生成硫酸钠和Cl2,根据S、O原子比例关系可知,应有氧气参与反应,反应化学方程式为2NaCl+SO2+O2$\frac{\underline{\;\;△\;\;}}{\;}$Na2SO4+Cl2,
故答案为:2NaCl+SO2+O2$\frac{\underline{\;\;△\;\;}}{\;}$Na2SO4+Cl2;
③发生反应:H2O2(l)+Cl2(g)=2HCl(g)+O2(g),
已知①2H2O2(l)═2H2O(l)+O2(g)△H1=-196.46kJ•mol-1
②H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H2=-285.84kJ•mol-1
③Cl2(g)+H2(g)═2HCl(g)△H3=-184.60kJ•mol-1
根据盖斯定律,①×$\frac{1}{2}$+③-②可得:H2O2(l)+Cl2(g)=2HCl(g)+O2(g),△H=(-196.46kJ•mol-1)×$\frac{1}{2}$+(-184.60kJ•mol-1)-(-285.84kJ•mol-1)=+3.01kJ•mol-1,故热化学方程式为:H2O2(l)+Cl2(g)=2HCl(g)+O2(g)△H=+3.01 kJ/mol,
故答案为:H2O2(l)+Cl2(g)=2HCl(g)+O2(g)△H=+3.01 kJ/mol;
(4)由NaCl溶液$→_{Ⅰ}^{80℃,通电}$NaClO3溶液可知,I中阳极上Cl失去电子,则阳极反应为Cl--6e-+3H2O═ClO-3+6H+,故答案为:Cl--6e-+3H2O═ClO-3+6H+;
(5)①根据图象知,D中Cl元素化合价为+7价,所以ClOx-中x为4,则D为ClO4-,故答案为:ClO4-;
②B→A+C,根据转移电子守恒得该反应方程式为3ClO-=ClO3-+2Cl-,△H=(63kJ/mol+2×0kJ/mol)-3×60kJ/mol=-117kJ/mol,所以生成1molC时,放出117kJ热量,热化学方程式为3ClO-(aq)═ClO3-(aq)+2Cl-(aq)△H=-117kJ•mol-1,
故答案为:3ClO-(aq)═ClO3-(aq)+2Cl-(aq)△H=-117kJ•mol-1.
点评 本题考查物质的性质及反应原理,为高频考点,把握物质的性质、发生的反应、盖斯定律计算反应热、电解等为解答的关键,侧重元素化合物知识及反应原理的综合考查,题目难度不大.

 名校课堂系列答案
名校课堂系列答案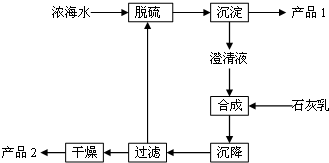 将海水淡化后,从剩余的浓海水中通过一系列工艺流程可以生产其他产品.
将海水淡化后,从剩余的浓海水中通过一系列工艺流程可以生产其他产品.(1)Cl2可以氧化浓海水中的Br-,用空气吹出Br2,并用纯碱吸收.纯碱吸收溴的主要反应是Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3(化学方程式未配平),则吸收1mol Br2时,该反应转移的电子为$\frac{5}{3}$mol.
(2)精制浓海水可以得到纯净的饱和食盐水,向其中加入碳酸氢铵可制备碳酸氢钠.
①NaCl的电子式是
 .
.②上述制备碳酸氢钠的化学方程式是NaCl+NH4HCO3═NaHCO3↓+NH4Cl.
③为测定制得的碳酸氢钠的纯度,可称量a g碳酸氢钠样品(含少量NaCl)溶于足量盐酸,蒸干溶液后灼烧,剩余固体质量为b g.样品碳酸氢钠的质量分数是$\frac{84(a-b)}{25.5a}$×100%(用含a、b的代数式表示).
(3)海水提取镁的一段工艺流程如图:
浓海水中的有关成分如下:
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
②产品2的化学式为Mg(OH)2;1L浓海水最多可得到产品2的质量为69.6 g.
| A. | 氧化铝是一种比较好的耐火材料,它可以用来制造耐火坩埚等实验仪器 | |
| B. | 一般合金的硬度大于它的纯金属成分,合金的熔点低于它的成分金属 | |
| C. | 碳酸钠晶体在干燥空气里容易逐渐失去结晶水变成碳酸钠粉末 | |
| D. | Fe3O4是一种复杂的化合物,俗称磁性氧化铁,常用于制作红色油漆和涂料 |
 硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制备绿矾.
硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制备绿矾.
 .
.
 .
.