题目内容
8.2.24g铁屑与30mL2mol/L盐酸充分反应后,溶液中FeCl2的物质的量为( )| A. | 0.02 mol | B. | 0.03mol | C. | 0.04mol | D. | 0.06mol |
分析 发生反应:Fe+2HCl=FeCl2+H2↑,根据方程式进行过量计算,根据不足量的物质计算FeCl2的物质的量.
解答 解:2.24g铁屑的物质的量=$\frac{2.24g}{56g/mol}$=0.04mol,30mL 2mol/L盐酸中n(HCl)=0.03L×2mol/L=0.06mol,
Fe+2 HCl=FeCl2+H2↑
1 2
0.04mol x
x=$\frac{0.04mol×2}{1}$=0.08mol>0.06mol,故盐酸不足,由方程式可知生成FeCl2的物质的量=0.06mol×$\frac{1}{2}$=0.03mol,
故选B.
点评 本题考查化学方程式计算,比较基础,注意两种反应物的量都已知,需要进行过量计算.

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目
3.下列除去杂质的操作方法正确的是( )
| A. | 食盐中有少量的NH4Cl:加过量的烧碱溶液后加热蒸干 | |
| B. | 氯化铵中少量的碘:加热 | |
| C. | CO2中混有少量的HCl:通过饱和的NaHCO3溶液后再干燥 | |
| D. | N2中混有少量的NO2:通过水洗涤 |
13.香樟树中可提取一种有机物樟脑(键线式如图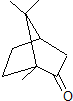 ),下列有关说法正确的是( )
),下列有关说法正确的是( )
 ),下列有关说法正确的是( )
),下列有关说法正确的是( )| A. | 樟脑的分子式为C10H18O | |
| B. | 樟脑中含有2种官能团 | |
| C. | 樟脑在一定条件下可以发生消去反应 | |
| D. | 樟脑有一种特殊的气味,但不属于芳香烃类物质 |
20.都能用氢氧化钠溶液进行喷泉实验的一组气体是( )
| A. | HCl和CO2 | B. | NH3和CO | C. | SO2和CO | D. | NO2和NO |