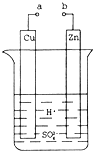
题目内容
下列有关说法正确的是
| A.4CuO(s)=2Cu2O(s)-+O2(g)在室温下不能自发进行,说明该反应△H<0 |
| B.生铁和纯铁同时放入海水中,纯铁更易腐蚀 |
| C.常温下,PbSO4易溶于pH=7的CH3COONH4溶液,说明((CH3COO)2Pb是弱电解质 |
D.H2S(g)+FeO(s)  FeS(s)+H2O(g),其他条件不变时增大压强,反应速v(H2S)和H2S的平衡转化率均增大 FeS(s)+H2O(g),其他条件不变时增大压强,反应速v(H2S)和H2S的平衡转化率均增大 |
C
试题分析:A、反应由固体转变生成气体,熵增加,若反应不能自发,则该反应一定是吸热反应,错误;B、生铁是铁和碳的混合物,两者构成原电池,在海水中的腐蚀快,错误;C、PbSO4与CH3COONH4反应生成(NH4)2SO4和Pb (CH3COO)2,(NH4)2SO4不是沉淀、也不是气体和弱电解质,但要满足复分解反应的条件,则Pb (CH3COO)2必须是弱电解质,正确;D、压强增加,反应速率加快,平衡向气体体积减小的方向进行,而该反应为等体积变化,故平衡不移动,错误。

练习册系列答案
 字词句段篇系列答案
字词句段篇系列答案
相关题目
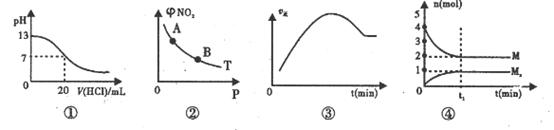
 N2O4(g)达到平衡时NO2的体积分数
N2O4(g)达到平衡时NO2的体积分数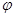 (NO2)随压强P的变化如图②所示,则A点的颜色深,B点的颜色浅
(NO2)随压强P的变化如图②所示,则A点的颜色深,B点的颜色浅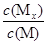 将增大
将增大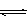 CH3OH(g)
CH3OH(g)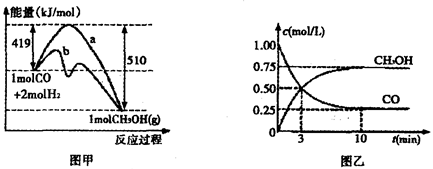
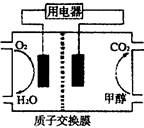
 2C(g)达平衡后,恒温,增压,平衡正向移动,平衡常数K值增大
2C(g)达平衡后,恒温,增压,平衡正向移动,平衡常数K值增大