题目内容
下列说法违背化学原理的是
| A.SO2的催化氧化是一个放热的反应,升高温度,反应速率加快 |
| B.“冰,水为之,而寒于水”说明相同质量的水和冰,水的能量较高 |
C.A(g)+3B(g)  2C(g)达平衡后,恒温,增压,平衡正向移动,平衡常数K值增大 2C(g)达平衡后,恒温,增压,平衡正向移动,平衡常数K值增大 |
| D.在KI溶液中加入氯化银固体,沉淀变成黄色,说明同温度下Ksp(AgI)< Ksp(AgCl) |
C
试题分析:C项:平衡常数K值减小,故错。故选C。
点评:本题重点考查的是化学基本原理的相关知识。难度易。比较基础,注意基础知识的积累和掌握。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
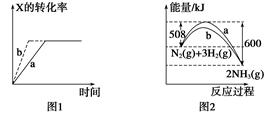
 3Z(g),b的压强一定比a大
3Z(g),b的压强一定比a大 FeS(s)+H2O(g),其他条件不变时增大压强,反应速v(H2S)和H2S的平衡转化率均增大
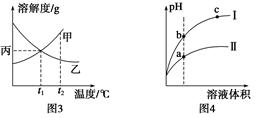
FeS(s)+H2O(g),其他条件不变时增大压强,反应速v(H2S)和H2S的平衡转化率均增大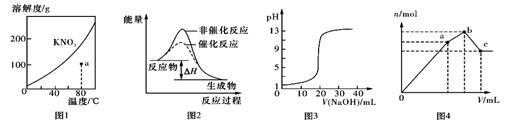
 CH3OH(g)+H2O(g),某些化学键的键能数据如下表:
CH3OH(g)+H2O(g),某些化学键的键能数据如下表:
 N204(g),相同时间后测得N02含量的曲线,则该反应的△H<O
N204(g),相同时间后测得N02含量的曲线,则该反应的△H<O CH3OH(g) ΔH,
CH3OH(g) ΔH,