题目内容
高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g) △H
(1)已知:①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) △H1="+489.0" KJ·mol-1
②C(石墨)+CO2(g)=2CO(g) △H2=+172.5KJ·mol-1
则△H= KJ?mol-1。
(2)高炉炼铁反应的平衡常数表达式K= ,温度升高后,K值 (填“增大”、“不变”或“减小”)。
(3)在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
①甲容器中CO的平衡转化率为 。
②下列说法正确的是 (填字母)。
A.当容器内气体密度恒定,表明反应达到平衡状态
B.甲容器中CO的平衡时的速率小于乙容器中CO平衡时的速率
C.甲、乙容器中,CO的平衡浓度之比为3:2
D.增加Fe2O3的量可以提高CO的转化率
(4)汽车尾气是城市空气污染的一个重要因素,一种CO分析仪的传感器可测定汽车尾气是否符合排放标准,该分析仪的工作原理类似燃料电池,其中电解质是氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在高温熔融状态下能传导O2-(过程中无气体产生),则负极的反应式为 。
Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g) △H
(1)已知:①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) △H1="+489.0" KJ·mol-1
②C(石墨)+CO2(g)=2CO(g) △H2=+172.5KJ·mol-1
则△H= KJ?mol-1。
(2)高炉炼铁反应的平衡常数表达式K= ,温度升高后,K值 (填“增大”、“不变”或“减小”)。
(3)在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
| | Fe2O3 | CO | Fe | CO2 |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
①甲容器中CO的平衡转化率为 。
②下列说法正确的是 (填字母)。
A.当容器内气体密度恒定,表明反应达到平衡状态
B.甲容器中CO的平衡时的速率小于乙容器中CO平衡时的速率
C.甲、乙容器中,CO的平衡浓度之比为3:2
D.增加Fe2O3的量可以提高CO的转化率
(4)汽车尾气是城市空气污染的一个重要因素,一种CO分析仪的传感器可测定汽车尾气是否符合排放标准,该分析仪的工作原理类似燃料电池,其中电解质是氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在高温熔融状态下能传导O2-(过程中无气体产生),则负极的反应式为 。
(1)-28.5kJ/mol (2) K=
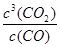 ,减小 (3)①60% ②AB; (4)CO-2e-+2O2-=CO32-
,减小 (3)①60% ②AB; (4)CO-2e-+2O2-=CO32-试题分析:(1)①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1 ="+489.0" KJ·mol-1① C(石墨)+CO2 (g)=2CO(g)△H2 =+172.5KJ·mol-1②;由①-②×3,得到热化学方程式:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=△H1-3△H2=-28.5kJ/mol;(2)反应Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)的平衡常数K=
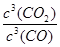 ,正反应方向为放热方向,升温平衡关系逆向移动,化学平衡常数减小;
,正反应方向为放热方向,升温平衡关系逆向移动,化学平衡常数减小;(3)①令平衡时CO的物质的量变化为nmol,则:
Fe2O3(s)+3CO(g)?Fe(s)+3CO2(g)
开始(mol): 1 1 1 1
变化(mol): n n n n
平衡(mol): 1-n 1-n 1+ n 1+ n
所以K=
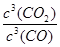 =(n+1)3/(1-n)3=64,解得n=0.6,所以CO的平衡转化率为0.6mol/1mol×100%=60%;②A.该容器的体积保持不变,根据质量守恒定律知,反应前后混合气体的质量会变,所以容器内气体的密度会变,当容器中气体的密度不再发生变化时,能表明达到化学平衡状态,故A正确;B.该反应是反应前后气体体积没有变化的反应,增加反应物气体的物质的量平衡不发生移动,但乙提高反应物浓度,乙反应容器中平衡是化学反应速率加快,故B正确;C.该反应是反应前后气体体积没有变化的反应,增加反应物气体的物质的量平衡不发生移动,甲、乙容器中,CO的平衡浓度之比为1:2 ;D.固体浓度保持不变,增加Fe2O3的量浓度不变,不能提高CO的转化率。(4)通一氧化碳气体的为负极,负极相关的化学方程式:CO-2e-+2O2-=CO32-。
=(n+1)3/(1-n)3=64,解得n=0.6,所以CO的平衡转化率为0.6mol/1mol×100%=60%;②A.该容器的体积保持不变,根据质量守恒定律知,反应前后混合气体的质量会变,所以容器内气体的密度会变,当容器中气体的密度不再发生变化时,能表明达到化学平衡状态,故A正确;B.该反应是反应前后气体体积没有变化的反应,增加反应物气体的物质的量平衡不发生移动,但乙提高反应物浓度,乙反应容器中平衡是化学反应速率加快,故B正确;C.该反应是反应前后气体体积没有变化的反应,增加反应物气体的物质的量平衡不发生移动,甲、乙容器中,CO的平衡浓度之比为1:2 ;D.固体浓度保持不变,增加Fe2O3的量浓度不变,不能提高CO的转化率。(4)通一氧化碳气体的为负极,负极相关的化学方程式:CO-2e-+2O2-=CO32-。
练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目


 CH3OH(g) △H = —90.8kJ/mol。
CH3OH(g) △H = —90.8kJ/mol。 O2(g)=H2O(g) △H = —241.8kJ/mol;
O2(g)=H2O(g) △H = —241.8kJ/mol; H2(g)+ CO2(g) △H<0,某温度下该反应的平衡常数K=1。若起始时c(CO)=1mol?L-1,c(H2O)=2mol?L-1,试回答下列问题:
H2(g)+ CO2(g) △H<0,某温度下该反应的平衡常数K=1。若起始时c(CO)=1mol?L-1,c(H2O)=2mol?L-1,试回答下列问题:
 FeS(s)+H2O(g),其他条件不变时增大压强,反应速v(H2S)和H2S的平衡转化率均增大
FeS(s)+H2O(g),其他条件不变时增大压强,反应速v(H2S)和H2S的平衡转化率均增大
 N2(g)+2H2O(l) △H="-a" kJ/mol
N2(g)+2H2O(l) △H="-a" kJ/mol Cu2O+H2↑,则阳极反应式为: 。
Cu2O+H2↑,则阳极反应式为: 。 2H2(g)+O2(g) △H=+484 kJ·mol-1
2H2(g)+O2(g) △H=+484 kJ·mol-1
