题目内容
甲醇是重要的化工原料,在日常生活中有着广泛的应用。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
反应Ⅱ:CO2(g)+3H2(g)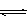 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
①在以上制备甲醇的两个反应中:反应Ⅰ优于反应Ⅱ,原因为_________________。
②对于反应Ⅰ,下图甲表示能量的变化;图乙表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时闻峦化。
在“图甲”中,曲线__________(填:“a”或“b”)表示使用了催化剂;该反应属于________(填:“吸热”、“放热”)反应。在图乙中从反应开始到建立平衡,用H2浓度变化表示的反应速率为_____________;该温度下CO(g)+2H2(g)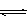 CH3OH(g)的化学平衡常数为__________.
CH3OH(g)的化学平衡常数为__________.
③对于反应Ⅱ,在一定温度时,将lmol CO2年和3mol H2充入一密闭恒容容器中,充分反应达到平衡后,若CO2的转化率为a,则容器内的平衡压强与起始压强之比为__________;若容器容积不变,下列措施可增加甲醇产率的是____________。
a.升高温度
b.增加CO2的量
c.充入He,使体系总压强增大
d.按原比例再充入CO2和H2
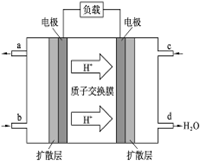
(2)甲醇对水质会造成一定的污染,有一种电化学法可消除这种 污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。实验室用下图装置模拟上述过程。
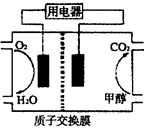
①阳极电极反应式为____________。
②除去甲醇的离子方程式为________________。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)
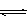 CH3OH(g)
CH3OH(g)反应Ⅱ:CO2(g)+3H2(g)
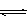 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)①在以上制备甲醇的两个反应中:反应Ⅰ优于反应Ⅱ,原因为_________________。
②对于反应Ⅰ,下图甲表示能量的变化;图乙表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时闻峦化。

在“图甲”中,曲线__________(填:“a”或“b”)表示使用了催化剂;该反应属于________(填:“吸热”、“放热”)反应。在图乙中从反应开始到建立平衡,用H2浓度变化表示的反应速率为_____________;该温度下CO(g)+2H2(g)
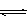 CH3OH(g)的化学平衡常数为__________.
CH3OH(g)的化学平衡常数为__________.③对于反应Ⅱ,在一定温度时,将lmol CO2年和3mol H2充入一密闭恒容容器中,充分反应达到平衡后,若CO2的转化率为a,则容器内的平衡压强与起始压强之比为__________;若容器容积不变,下列措施可增加甲醇产率的是____________。
a.升高温度
b.增加CO2的量
c.充入He,使体系总压强增大
d.按原比例再充入CO2和H2
(2)甲醇对水质会造成一定的污染,有一种电化学法可消除这种 污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。实验室用下图装置模拟上述过程。

①阳极电极反应式为____________。
②除去甲醇的离子方程式为________________。
(14分)(1)①反应I符合“原子经济性”的原则即原子利用率为100%(1分)
②b(1分) 放热(1分) 0.15mol/(L·min)(2分) 12(1分)③1-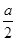 (2分) bd(2分)
(2分) bd(2分)
(2)①CO2+-e-=CO3+(2分)
②6 CO3++CH3OH+H2O=CO2↑+6 CO2++6H+(2分)
②b(1分) 放热(1分) 0.15mol/(L·min)(2分) 12(1分)③1-
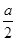 (2分) bd(2分)
(2分) bd(2分)(2)①CO2+-e-=CO3+(2分)
②6 CO3++CH3OH+H2O=CO2↑+6 CO2++6H+(2分)
试题分析:(1)①根据反应I和反应Ⅱ的生成物可知,反应I中生成物只有一种,而反应Ⅱ中还有水生成,即反应I符合“原子经济性”的原则即原子利用率为100%,所以反应Ⅰ优于反应Ⅱ。
②根据图像甲可知,曲线b的活化能低于曲线a的活化能,所以曲线b表示使用了催化剂;同样根据图像甲可知,反应物的总能量高于生成物的总能量,所以反应是放热反应;根据图像乙可知,反应进行到10min是反应达到平衡状态,此时生成的甲醇浓度是0.75mol/L,则根据反应I可知,消耗氢气的浓度是1.5mol/L,所以氢气表示的反应速率是1.5mol/L÷10min=0.15mol/(L·min);平衡时氢气的浓度是2mol/L-1.5mol/L=0.5mol/L,所以根据CO和甲醇的平衡浓度可知,该温度下反应的平衡常数K=
 =12。
=12。③ CO2(g)+3H2(g)
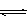 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)起始量(mol/L) 1 3 0 0
转化量(mol/L) a 3a a a
平衡量(mol/L) 1-a 3-3a a a
则根据压强之比是相应的物质的量之比可知
容器内的平衡压强与起始压强之比为
 =1-
=1-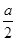
a.因正反应放热,升高温度可使平衡向逆反应方向移动,不能增加甲醇产率,故a不正确;
b.增加CO2的量,平衡向正反应方向移动,所以可以增加甲醇产率,故b正确;
c.充入He,使体系总压强增大,对于参加反应的物质来说,浓度不变,平衡不移动,甲醇产率不变,故c错误;
d.按原比例再充入CO2和H2压强增大,平衡向正反应方向移动,可以增加甲醇产率,故d正确。
答案选bd。
(2)①原电池中阳极失去电子,所以根据装置图可知,CO2+在阳极失去电子,阳极电极反应式为CO2+-e-=CO3+。
②Co3+做氧化剂,能把水中的甲醇氧化成CO2而净化,反应的离子方程式是6 CO3++CH3OH+H2O=CO2↑+6 CO2++6H+。

练习册系列答案
相关题目
 CH3OH(g) △H = —90.8kJ/mol。
CH3OH(g) △H = —90.8kJ/mol。 O2(g)=H2O(g) △H = —241.8kJ/mol;
O2(g)=H2O(g) △H = —241.8kJ/mol; H2(g)+ CO2(g) △H<0,某温度下该反应的平衡常数K=1。若起始时c(CO)=1mol?L-1,c(H2O)=2mol?L-1,试回答下列问题:
H2(g)+ CO2(g) △H<0,某温度下该反应的平衡常数K=1。若起始时c(CO)=1mol?L-1,c(H2O)=2mol?L-1,试回答下列问题:
 FeS(s)+H2O(g),其他条件不变时增大压强,反应速v(H2S)和H2S的平衡转化率均增大
FeS(s)+H2O(g),其他条件不变时增大压强,反应速v(H2S)和H2S的平衡转化率均增大
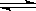 CH3OH(g) ΔH< 0。
CH3OH(g) ΔH< 0。