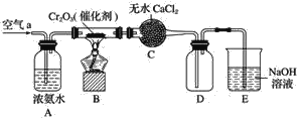
题目内容
【题目】某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
实验序号 | 实验 温度/K | 有关物质 | 溶液颜色褪至无色所需时间/s | ||||
酸性KMnO4溶液 | H2C2O4溶液 | H2O | |||||
V/mL | c/mol·L-1 | V/mL | c/mol·L-1 | V/mL | |||
A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313 | 2 | 0.02 | V2 | 0.1 | 1 | t2 |
(1)通过实验A、B,可探究出___(填外部因素)的改变对化学反应速率的影响,其中V1=____、T1=____;通过实验___(填实验序号)可探究出温度变化对化学反应速率的影响,其中V2=____。
(2)若t1<8,则由此实验可以得出的结论是_____;忽略溶液体积的变化,利用实验B中数据计算,0~8s内,用KMnO4的浓度变化表示的反应速率v(KMnO4)=___。
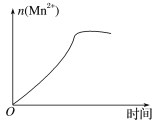
(3)该小组的一位同学通过查阅资料发现,上述实验过程中n(Mn2+)随时间的变化情况如图所示,并认为造成这种变化的原因是反应体系中的某种粒子对KMnO4与草酸之间的反应有某种特殊作用,则该作用是____,相应的粒子最可能是___(填粒子符号)。
【答案】浓度 1 293 B、C 3 其他条件相同时,增大反应物浓度,反应速率增大 8.3×10-4mol·L-1·s-1 催化作用 Mn2+
【解析】
(1)A、B应控制温度相同,探究浓度对反应速率的影响,B、C温度不同可探究温度对反应速率的影响,研究某种因素对反应速率的影响时,需要保证气体条件相同,据此分析解答;
(2)若t1<8,则浓度越大,反应速率越大;结合v=![]() 计算;
计算;
(3)根据n(Mn2+)随时间的变化情况的图像,反应生成的锰离子可作催化剂加快反应速率。
(1)实验A、B,滴加H2C2O4溶液的体积不等,故实验A、B,可探究出H2C2O4浓度的改变对反应速率的影响;据实验A可知,保证溶液的总体积为6mL,B中H2C2O4溶液3mL,故需加水6mL-2mL-3mL=1mL;A、B研究浓度对化学反应速率的影响,需要温度相同,故T1=293;B、C温度不同,要探究出温度变化对化学反应速率的影响,其余条件相同,则V2=6mL-2mL-1mL=3mL;
(2)若t1<8,则由此实验可以得出的结论是其他条件相同时,增大反应物浓度,反应速率增大;根据实验B中数据可知,高锰酸钾完全反应需要的时间为8s,高锰酸钾的物质的量为0.02molL-1×0.002L=0.00004mol,混合后溶液中高锰酸钾的浓度为![]() =
=![]() ×10-3mol/L,则用KMnO4的浓度变化表示的反应速率为
×10-3mol/L,则用KMnO4的浓度变化表示的反应速率为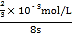 =8.3×10-4mol/(L·s);
=8.3×10-4mol/(L·s);
(3)根据n(Mn2+)随时间的变化情况的图像,反应一段时间后该反应速率会加快,造成此种变化的原因是反应体系中的某种粒子对KMnO4与H2C2O4之间的反应有某种特殊的作用,则该作用是催化作用,相应的粒子最有可能的是Mn2+。

 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案【题目】自然界中存在大量的元素,如钠、镁、铝、铁、铜、砷、锌、镍等在生活中有着广泛的应用。
(1)请写出Fe的基态原子核外电子排布式________,砷属于________区元素。
(2)金属A的原子只有3个电子层,其第一至第四电离能如下:
电离能 |
|
|
|
|
A | 932 | 1821 | 15390 | 21771 |
则A原子的价电子排布式为___________________________。
(3)锌化铜是一种金属互化物,其化学式有多种形式,如![]() ,
,![]() ,
,![]() 等。其中所含元素铜的第二电离能________(填“大于”“小于”或“等于”)锌的第二电离能。
等。其中所含元素铜的第二电离能________(填“大于”“小于”或“等于”)锌的第二电离能。
(4)用锌还原![]() 的盐酸溶液,经后续处理可制得绿色的晶体
的盐酸溶液,经后续处理可制得绿色的晶体![]() 。该晶体所含元素中,电负性最大的元素是________,与Ti形成配位键的配体是________,
。该晶体所含元素中,电负性最大的元素是________,与Ti形成配位键的配体是________,![]() 该配合物中含有
该配合物中含有![]() 键的数目为________。
键的数目为________。
(5)![]() 能形成多种配离子,如
能形成多种配离子,如![]() ,
,![]() 等。
等。![]() 的空间构型为:________;与
的空间构型为:________;与![]() 互为等电子体的分子有:___________________(填分子式)。
互为等电子体的分子有:___________________(填分子式)。
(6)铜的化合物种类很多,如图是氯化亚铜的晶胞结构(黑色球表示![]() ,白色球表示
,白色球表示![]() ),已知晶胞的棱长为acm,则氯化亚铜密度的计算式为ρ=________
),已知晶胞的棱长为acm,则氯化亚铜密度的计算式为ρ=________![]() (用
(用![]() 表示阿伏加德罗常数)
表示阿伏加德罗常数)