题目内容
(9分)在2 L密闭容器内,800℃时反应2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
(1)写出该反应的平衡常数表达式:K=__________.已知:K300℃>K350℃,则该反应是________热反应.
(2)图中表示NO2的变化的曲线是________.用O2表示从0~2 s内该反应的平均速率v=________

(3)能说明该反应已达到平衡状态的是________.
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是________.
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)图中表示NO2的变化的曲线是________.用O2表示从0~2 s内该反应的平均速率v=________

(3)能说明该反应已达到平衡状态的是________.
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是________.
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
(9分)(1)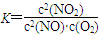 ,放热反应.(2)b v=1.5×10-3mol/(L·s)
,放热反应.(2)b v=1.5×10-3mol/(L·s)
(3)bc.(4)c.
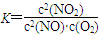 ,放热反应.(2)b v=1.5×10-3mol/(L·s)
,放热反应.(2)b v=1.5×10-3mol/(L·s)(3)bc.(4)c.
(1)平衡常数是在一定条件下,可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据方程式可知,平衡常数表达式是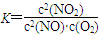 ;升高温度平衡常数减小,所以正反应是放热反应。
;升高温度平衡常数减小,所以正反应是放热反应。
(2)平衡时消耗NO的是0.013mo,则生成NO2是0.013mol,其浓度是0.013mol÷2L=0.0065mol/L,所以b曲线表示NO2的;0~2 s内消耗NO是0.012ml,则消耗氧气是0.006mol其浓度是0.006mol÷2L=0.003mol/L,所以用氧气表示的反应速率是0.003mol/L÷2s=1.5×10-3mol/(L·s).
(3)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。A中反应速率的的关系是恒成立的,不能说明;根据反应的方程式可知,反应前后体积减小,所以压强也是减小的,因此选项b正确;c中反应速率的方向相反,且满足速率之比是相应的化学计量数之比,正确;密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,因此d不正确,答案选bc。
(4)a降低生成物的浓度,反应速率降低;升高温度平衡向逆反应方向进行,b不正确;催化剂不能改变平衡状态,d不正确,所以正确的答案选c。
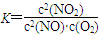 ;升高温度平衡常数减小,所以正反应是放热反应。
;升高温度平衡常数减小,所以正反应是放热反应。(2)平衡时消耗NO的是0.013mo,则生成NO2是0.013mol,其浓度是0.013mol÷2L=0.0065mol/L,所以b曲线表示NO2的;0~2 s内消耗NO是0.012ml,则消耗氧气是0.006mol其浓度是0.006mol÷2L=0.003mol/L,所以用氧气表示的反应速率是0.003mol/L÷2s=1.5×10-3mol/(L·s).
(3)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。A中反应速率的的关系是恒成立的,不能说明;根据反应的方程式可知,反应前后体积减小,所以压强也是减小的,因此选项b正确;c中反应速率的方向相反,且满足速率之比是相应的化学计量数之比,正确;密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,因此d不正确,答案选bc。
(4)a降低生成物的浓度,反应速率降低;升高温度平衡向逆反应方向进行,b不正确;催化剂不能改变平衡状态,d不正确,所以正确的答案选c。

练习册系列答案
相关题目
 2Z,其平衡常数为1600
2Z,其平衡常数为1600 2C(g)在固定容积的密闭容器中进行。若向容器中充入1molA和1molB,在T℃达平衡时,C的体积分数为m%;若向容器中充入2molC,T℃达平衡时,C的体积分数为n%;若向容器中充入1molC,T℃达平衡时,C的体积分数为p%。则m、n、p的关系是
2C(g)在固定容积的密闭容器中进行。若向容器中充入1molA和1molB,在T℃达平衡时,C的体积分数为m%;若向容器中充入2molC,T℃达平衡时,C的体积分数为n%;若向容器中充入1molC,T℃达平衡时,C的体积分数为p%。则m、n、p的关系是 

 ,其正反应为放热反应,如果反应在密闭容器中进行,下列有关说法中正确的是( )
,其正反应为放热反应,如果反应在密闭容器中进行,下列有关说法中正确的是( )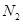 、
、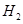 、
、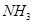 的浓度之比为1:3:2
的浓度之比为1:3:2 pC(g) + qD(g)的平衡常数为K,下列说法正确的是( )
pC(g) + qD(g)的平衡常数为K,下列说法正确的是( ) 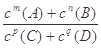
 2NH3,△H<0的关系的是( )
2NH3,△H<0的关系的是( )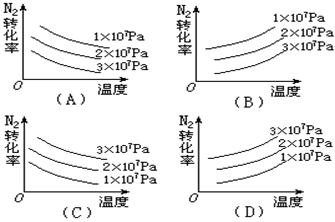
 CH3CH2OH(g)+H2O(g) △H=—255.6 kJ·mol—1,下列说法错误的是
CH3CH2OH(g)+H2O(g) △H=—255.6 kJ·mol—1,下列说法错误的是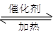 7N2+12 H2O可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
7N2+12 H2O可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。 2SO3(g) ΔH= —196.6 kJ·mol-1
2SO3(g) ΔH= —196.6 kJ·mol-1
 CO(g)+3H2(g) △H>0。
CO(g)+3H2(g) △H>0。 CH3OH(g),CO的平衡转化率与温度、压强的关系如右图所示,则:
CH3OH(g),CO的平衡转化率与温度、压强的关系如右图所示,则: