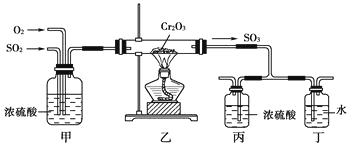
��Ŀ����
����Ŀ�����з�ӦmA��g��+nB��g��pC��g�����ﵽƽ��������¶�ʱ��B��ת���ʼ�С������Сѹǿʱ�������ϵ��A����������������
��1���÷�Ӧ������Ӧ���ȷ�Ӧ����m+np �����������������=������
��2������ѹǿʱ��B��ת���������������С�����䡱����ͬ�����淴Ӧ���� ��
��3��������C��������䣩����A��������� ��
��4���������¶ȣ���ƽ��ʱB��C��Ũ��֮�� ![]() ��ֵ�� ��
��ֵ�� ��
��5��������������÷�Ӧ�ķ�Ӧ�� ��
��6����B����ɫ���ʣ�A��C��Ϊ��ɫ���ʣ�ά������������䣬��������ʱ������������ɫ�����dz������������䡱����
���𰸡�
��1���ţ���
��2����������
��3����С
��4������
��5������
��6������
���������⣺��1���ﵽƽ��������¶�ʱ��B��ת���ʼ�С��˵���¶�����ƽ�����淴Ӧ�����ƶ���������Ӧ���ȣ�����Сѹǿʱ�������ϵ��A��������������˵��ѹǿ��Сƽ�����淴Ӧ�����ƶ�����ʽ�з�Ӧ�������ļ�����֮�ʹ�������������Ļ�ѧ������֮�ͣ����Դ��ǣ��ţ�������2������ѹǿʱ��ƽ�����ŷ���ʽ������ļ�����֮������ķ�Ӧ�����ƶ�������������Ӧ�����ƶ�����B������������С������ѹǿ���淴Ӧ���ʶ��ӿ죬���Դ��ǣ���С������3��������C��������䣩���൱������ѹǿ����ƽ����������Ӧ�����ƶ�����A�����������С�����Դ��ǣ���С����4������Ӧ���ȣ��������¶ȣ�ƽ�������ƶ���C�����ʵ������࣬B�����ʵ�����С�����Զ��ߵ�Ũ�ȱ�ֵ���������Դ��ǣ�����5�������Ի�ѧƽ���ƶ�û��Ӱ�죬����������������÷�Ӧ�ķ�Ӧ�Ȳ��䣬���Դ��ǣ����䣻��6����B����ɫ���ʣ�A��C��Ϊ��ɫ���ʣ���������ʱ��ƽ�ⲻ�ƶ�������ֵ����ʵ������䣬ά������������䣬���Ը���ֵ�Ũ�Ȳ��䣬����������ɫ���䣬 ���Դ��ǣ����䣮
�����㾫����������Ĺؼ������������ȷ�Ӧ�ͷ��ȷ�Ӧ�����֪ʶ�����ջ�ѧ�ϰ����������Ļ�ѧ��Ӧ��Ϊ���ȷ�Ӧ����ѧ�ϰѷų������Ļ�ѧ��Ӧ��Ϊ���ȷ�Ӧ���Լ��Ի�ѧƽ��״̬���ʼ����������⣬�˽⻯ѧƽ��״̬�����������ȡ��� V��=V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ�����������䣬���淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч����

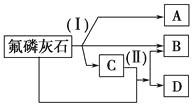
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ��Ԫ�����ڱ���ѧϰ��ѧ����Ҫ���ߣ���������������Ϣ���ɣ������ǰ��ֶ�����Ԫ�ص������Ϣ����֪���ԭ�Ӱ뾶Ϊ0.089nm��
Ԫ�ش��� | A | B | C | D | E |
ԭ�Ӱ뾶/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
��Ҫ���ϼ� | +2 | +3 | +6����2 | ��1 | ��2 |
Fԭ���������ӣ�G����������븺������ȣ��������������Ǵ����Ķ�����HԪ�ص�����ɫ��Ӧ�ʻ�ɫ��
��1��CԪ����Ԫ�����ڱ��е�λ�� �� B�γɵļ����ӵĽṹʾ��ͼ ��
��2����������Ԫ�ص�����������Ӧ��ˮ������������ǿ�������ѧʽ����
��3���õ���ʽ��ʾA��D�γɻ�����Ĺ��̣� ��
��4��H��E�γ�ԭ�Ӹ�����Ϊ1��1�Ļ�������������ѧ������Ϊ ��
��5��GE2�ĵ���ʽΪ �� F��G�γɵ���Ļ�����ĽṹʽΪ ��
��6��E���⻯���C���⻯����۷е�ߵ�ԭ���� ��
��7��A��B��C��Eԭ�Ӱ뾶�ɴ�С��˳��Ϊ����Ԫ�ط��ű�ʾ�� ��