��Ŀ����
����Ŀ������ý����Ҫ�Ĵ�����CO��������ý���õ�����ʧȥ�����ԣ�Fe+5CO=Fe��CO��5����ȥCO�Ļ�ѧ��Ӧ����ʽΪ��
[Cu��NH3��2]OOCCH3+CO+NH3=[Cu��NH3��3��CO��]OOCCH3 ��
��ش��������⣺
��1��C��N��O�ĵ縺���ɴ�С��˳��Ϊ �� ��̬Feԭ�ӵļ۵����Ų�ͼΪ ��
��2��Fe��CO��5�����ʻ�����������Ϊ��ɫ��״Һ�壬��Fe��CO��5�ľ��������� �� ��CO��Ϊ�ȵ�����ķ��ӵĵ���ʽΪ ��
��3�������[Cu��NH3��2]OOCCH3��̼ԭ�ӵ��ӻ������� �� �������ṩ�¶Ե��ӵ�ԭ���� ��
��4����[Cu��NH3��2]OOCCH3��ȥCO�ķ�Ӧ�У��϶����γɣ�
a�����Ӽ� b����λ�� c���Ǽ��Լ� d���ļ�
��5��NaAlH4����ľ�����ͼ��
��Na+�����ҵȾ��AlH4��������NaAlH4������ܶ�Ϊgcm��3���ú�a�Ĵ���ʽ��ʾ����
���𰸡�
��1��O��N��C��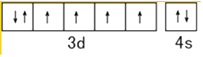
��2�����Ӿ��壻![]()
��3��sp3��sp2��N
��4��bd
��5��8��![]()
���������⣺��1��ͬһ����Ԫ�أ�Ԫ�ص縺������ԭ���������������������Ԫ�ص�һ�����ܴ�С˳����O��N��C��Feԭ��3d��4s�ܼ�����Ϊ��۵��ӣ���̬Feԭ�ӵļ۵����Ų�ͼΪ 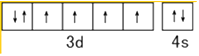 �����Դ��ǣ�O��N��C��
�����Դ��ǣ�O��N��C�� 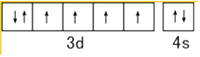 ����2���۷е�ϵ͵ľ���Ϊ���Ӿ��壬Fe��CO��5�����ʻ�����������Ϊ��ɫ��״Һ�壬���۷е�ϵͣ�Ϊ���Ӿ��壻��CO��Ϊ�ȵ�����ķ����ǵ������ӣ�����ʽΪ
����2���۷е�ϵ͵ľ���Ϊ���Ӿ��壬Fe��CO��5�����ʻ�����������Ϊ��ɫ��״Һ�壬���۷е�ϵͣ�Ϊ���Ӿ��壻��CO��Ϊ�ȵ�����ķ����ǵ������ӣ�����ʽΪ ![]() ��
��
���Դ��ǣ����Ӿ��壻 ![]() ����3�����������Cԭ�Ӽ۲���ӶԸ�����4��3�Ҳ����µ��Ӷԣ����ݼ۲���ӶԻ�������ȷ��Cԭ���ӻ���ʽΪsp3��sp2 �� ��������Cuԭ���ṩ�չ����Nԭ���ṩ�µ��Ӷԣ�
����3�����������Cԭ�Ӽ۲���ӶԸ�����4��3�Ҳ����µ��Ӷԣ����ݼ۲���ӶԻ�������ȷ��Cԭ���ӻ���ʽΪsp3��sp2 �� ��������Cuԭ���ṩ�չ����Nԭ���ṩ�µ��Ӷԣ�
���Դ��ǣ�sp3��sp2��N����4����[Cu��NH3��2]OOCCH3��ȥCO�ķ�Ӧ�У��϶���Cuԭ�Ӻ�N��Cԭ��֮�����λ����Ҳ�Ǧļ����ɣ�
��ѡbd����5�����ݾ�̯����֪��������AlH4����ĿΪ1+8�� ![]() +4��
+4�� ![]() =4��Na+��ĿΪ6��
=4��Na+��ĿΪ6�� ![]() +4��
+4�� ![]() =4���������λ��Ϊ1��1�������ĵ�AlH4���о�����֮�����ҵȾ��Na+λ�ھ�����֮�䡢�������������������Ҳ������ġ�����������������ǰ��������ģ���AlH4�������ҵȾ��Na+��8��������Na+�����ҵȾ��AlH4����8����
=4���������λ��Ϊ1��1�������ĵ�AlH4���о�����֮�����ҵȾ��Na+λ�ھ�����֮�䡢�������������������Ҳ������ġ�����������������ǰ��������ģ���AlH4�������ҵȾ��Na+��8��������Na+�����ҵȾ��AlH4����8����
��������Ϊ4�� ![]() g�������ܶ�Ϊ4��
g�������ܶ�Ϊ4�� ![]() g��[��a��10��7 cm��2��2a��10��7 cm]=
g��[��a��10��7 cm��2��2a��10��7 cm]= ![]() gcm��3 ��
gcm��3 ��
���Դ��ǣ�8�� ![]() ��
��


