题目内容
【题目】元素周期表是学习化学的重要工具,它隐含着许多信息和规律.下面是八种短周期元素的相关信息(已知铍的原子半径为0.089nm)
元素代号 | A | B | C | D | E |
原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
主要化合价 | +2 | +3 | +6,﹣2 | ﹣1 | ﹣2 |
F原子中无中子,G最高正价数与负价数相等,且最外层电子数是次外层的二倍,H元素单质焰色反应呈黄色.
(1)C元素在元素周期表中的位置 . B形成的简单离子的结构示意图 .
(2)上述八种元素的最高价氧化物对应的水化物中酸性最强的是(填化学式).
(3)用电子式表示A、D形成化合物的过程: .
(4)H、E形成原子个数比为1:1的化合物中所含化学键类型为 .
(5)GE2的电子式为 , F与G形成的最简单的化合物的结构式为 .
(6)E的氢化物比C的氢化物的熔沸点高的原因是 .
(7)A、B、C、E原子半径由大到小的顺序为(用元素符号表示) .
【答案】
(1)第三周期第ⅥA族;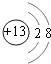
(2)HClO4
(3)![]()
(4)离子键、共价键
(5)![]() ;
;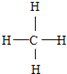
(6)H2O分子间存在氢键,H2S分子间不存在氢键
(7)Mg>Al>S>O
【解析】解:F原子中无中子,所以是H,G最高正价数与负价数相等,是且最外层电子数是次外层的二倍,所以G是C,H元素单质焰色反应呈黄色,则H为Na;C、E都有﹣2价,且C有最高正价+6,则C为S、E为O;D有﹣1价,原子半径大于氧,则D为Cl;A有+2价,处于ⅡA族,原子半径大于硫元素,则A为Mg;B有+3价,处于ⅢA族,原子半径大于硫原子,故B为Al.(1)C为S元素,处于周期表中第三周期第ⅥA族,B形成的简单离子为Al3+ , 离子结构示意图为 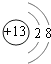 ,所以答案是:第三周期第ⅥA族;
,所以答案是:第三周期第ⅥA族; 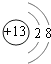 ;(2)上述八种元素的最高价氧化物对应的水化物中酸性最强的是HClO4 , 所以答案是:HClO4;(3)A、D形成化合物为MgCl2 , 用电子式表示过程为:
;(2)上述八种元素的最高价氧化物对应的水化物中酸性最强的是HClO4 , 所以答案是:HClO4;(3)A、D形成化合物为MgCl2 , 用电子式表示过程为: ![]() ,所以答案是:
,所以答案是: ![]() ;(4)H、E形成原子个数比为1:1的化合物为Na2O2 , 所含化学键类型为离子键、共价键,所以答案是:离子键、共价键;(5)CO2的电子式为
;(4)H、E形成原子个数比为1:1的化合物为Na2O2 , 所含化学键类型为离子键、共价键,所以答案是:离子键、共价键;(5)CO2的电子式为 ![]() ,F与G形成的最简单的化合物为CH4 , 结构式为
,F与G形成的最简单的化合物为CH4 , 结构式为 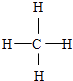 ,所以答案是:
,所以答案是: ![]() ;
;  ;(6)H2O分子间存在氢键,H2S分子间不存在氢键,故水的熔沸点较高,所以答案是:H2O分子间存在氢键,H2S分子间不存在氢键;(7)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:Mg>Al>S>O,所以答案是:Mg>Al>S>O.
;(6)H2O分子间存在氢键,H2S分子间不存在氢键,故水的熔沸点较高,所以答案是:H2O分子间存在氢键,H2S分子间不存在氢键;(7)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:Mg>Al>S>O,所以答案是:Mg>Al>S>O.

【题目】为提纯下列物质(括号内为杂质),选用的试剂和分离方法都正确的是
物质 | 试剂 | 分离方法 | |
① | 硝酸钾(氯化钠) | 蒸馏水 | 降温结晶 |
② | 二氧化碳(氯化氢) | 饱和碳酸钠溶液 | 洗气 |
③ | 乙醇(水) | 生石灰 | 蒸馏 |
④ | 苯(苯酚) | 浓溴水 | 分液 |
A.①②B.只有③C.①③D.③④
