题目内容
【题目】如下图所示的装置是仿照工业制备硫酸的工艺流程设计出来的,用于探究工业上为何采用98.3%的浓硫酸吸收三氧化硫。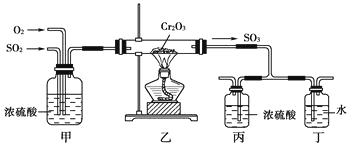
试填写下列空白:
(1)写出工业上用FeS2制取SO2的化学方程式:。
(2)写出上图中部分装置的作用:①甲;
②丙和丁:。
(3)若丁装置在反应过程中出现气泡,不久就出现了白雾,而丙装置一直没有明显变化,产生这种现象的可能原因是:①丙中插入浓硫酸中的导管插入太深,使两个吸收瓶内的压强差较大,导致SO3从丁的水中冒了出来,与水形成酸雾:②。
(4)上图装置中的甲和乙部分、丙和丁部分分别与工业制取硫酸的装置相对应,甲和乙相当于;丙和丁相当于。
(5)在硫酸工业制法中,下列对生产操作与说明生产操作的主要原因的叙述都正确的是________(填下列选项的序号)。
A.硫铁矿燃烧前需要粉碎,因为大块的硫铁矿不能在空气中燃烧
B.从沸腾炉出来的炉气需净化,因为炉气中二氧化碳会与杂质反应
C.二氧化硫氧化为三氧化硫时需使用催化剂,这样可以提高二氧化硫的转化率
D.三氧化硫用98.3%的浓硫酸溶液吸收,目的是防止形成酸雾,以提高三氧化硫的吸收效率
【答案】
(1)4FeS2+11O2 ![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
(2)①干燥SO2和O2;②吸收SO3并做对照实验
(3)②浓硫酸对SO3的吸收效果远好于水的吸收效果,SO3被浓硫酸充分吸收
(4)接触室;吸收塔
(5)D
【解析】甲装置除干燥SO2和O2外,还有2个作用:使原料混合均匀;通过观察气泡的多少控制气体的流量。浓H2SO4可以吸收大量SO3形成发烟硫酸。

【题目】为提纯下列物质(括号内为杂质),选用的试剂和分离方法都正确的是
物质 | 试剂 | 分离方法 | |
① | 硝酸钾(氯化钠) | 蒸馏水 | 降温结晶 |
② | 二氧化碳(氯化氢) | 饱和碳酸钠溶液 | 洗气 |
③ | 乙醇(水) | 生石灰 | 蒸馏 |
④ | 苯(苯酚) | 浓溴水 | 分液 |
A.①②B.只有③C.①③D.③④