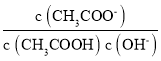题目内容
【题目】表是元素周期表的一部分,请用元素符号、离子符号或相关化学式回答有关问题:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)表中能形成两性氢氧化物的元素在周期表中的位置是________;
(2)写出②的气态氢化物的结构式________;
(3)元素④⑤⑥⑦离子半径由大到小的顺序________;
(4)①、⑥、⑦三种元素的最高价氧化物的水化物中酸性最强的是________;④、⑤、⑨三种元素的最高价氧化物的水化物中碱性最强的是
(5)⑦和⑩氧化性较强的是________用一个置换反应证实这一结论(写化学方程式)___________________________。
(6)④⑤两元素相比较,金属性较强的是________,可以验证该结论的实验是________;
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将形状、大小相同的这两种元素的单质用砂纸打磨后分别和同浓度的盐酸反应
(c)将形状、大小相同两种元素的单质用砂纸打磨后分别和热水作用,并滴入酚酞
(d)比较这两种元素的气态氢化物的稳定性
【答案】第三周期第ⅢA族 ![]() S2>Cl>Mg2+>Al3+ HClO4 KOH Cl Cl2+2Br-=2Cl-+Br2 Mg bc
S2>Cl>Mg2+>Al3+ HClO4 KOH Cl Cl2+2Br-=2Cl-+Br2 Mg bc
【解析】
由元素在周期表中的位置可知,①为C,②为N,③为F,④为Mg,⑤为Al,⑥为S,⑦为Cl,⑧为Ar,⑨为K,⑩为Br,以此解答。
(1)氢氧化铝为两性氢氧化物,则Al位于第三周期第ⅢA族;
(2)②的气态氢化物为氨气,氨气为三角锥型,其结构式为:![]() ;
;
(3)电子层越多,离子半径越大,具有相同电子排布的离子,原子序数大的离子半径小,元素④⑤⑥⑦离子半径由大到小的顺序为S2>Cl>Mg2+>Al3+;
(4)非金属性越强,元素的最高价氧化物对应水化物的酸性越强,则①、⑥、⑦三种元素的最高价氧化物的水化物中酸性最强的是HClO4;元素金属性越强,元素的最高价氧化物对应水化物的碱性越强,④、⑤、⑨中金属性最强的为K,因此碱性最强的是KOH;
(5)同主族元素从上至下,非金属性逐渐减弱,因此非金属性Cl>Br;根据氧化剂氧化性大于氧化产物证明,因此可利用Cl2+2Br-=2Cl-+Br2验证;
(6)④⑤两元素相比较,金属性Mg>Al,金属性较强的是Mg,
a.将在空气中放置已久的这两种元素的块状单质分别放入热水中,铝片表面有氧化膜,阻止与水的反应,故无法证明;
b.将形状、大小相同的这两种元素的单质用砂纸打磨后分别和同浓度的盐酸反应,与盐酸反应越剧烈的金属单质,其对应的金属性越强,可证明;
c.将形状、大小相同两种元素的单质用砂纸打磨后分别和热水作用,并滴入酚酞,其金属对应的最高价氧化物的水化物碱性越强,其元素的金属性越强,可证明;
d.比较这两种元素的气态氢化物的稳定性,用于比较非金属性,故不选;
故答案为:Mg;bc。

【题目】某温度下,H2(g)+CO2(g)![]() H2O(g)+CO2(g)的平衡常数
H2O(g)+CO2(g)的平衡常数![]() 。该温度下在甲、乙、丙三个恒容密闭容器中,
。该温度下在甲、乙、丙三个恒容密闭容器中,
起始浓度 | 甲 | 乙 | 丙 |
c(H2)/mol | 0.010 | 0.020 | 0.020 |
c(CO2)/mol | 0.010 | 0.010 | 0.020 |
投入H2(g)和CO2(g),其起始浓度如表所示。下列判断不正确的是( )
A.平衡时,乙中CO2的转化率大于60%
B.平衡时,甲中和丙中H2的转化率均是60%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.012mol/L
D.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
【题目】海水是一个巨大的化学资源宝库。

(1)海水中制得的氯化钠可用于生产烧碱及氯气,装置如图所示,下列说法正确的是____(填字母)。

A.阴极反应式是:Na++e-=Na
B.可以用铁做阴极,石墨做阳极
C.烧碱和氯气都在阳极生成
D.离子交换膜是阴离子交换膜(只允许阴离子通过)
(2)苦卤的主要成分是 MgCl2,此外还含 Fe2+、Fe3+、Al3+等离子。已知:生成氢氧化物沉淀的 pH
氢氧化物 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Al(OH)3 | 3.7 | 4.7 |
Mg(OH)2 | 9.6 | 11.1 |
① 步骤 i 中加入 NaClO 的作用是_____,_____。
② 步骤 ii 需在 HCl 保护气中加热进行,HCl 保护气的作用是_____。
③ 若向苦卤中加入石灰乳,可以得到 Mg(OH)2沉淀,用化学平衡移动原理解释该反应过程_____。
(3)海水淡化前需对海水进行预处理。用如图所示 NaClO 的发生装置对海水进行消毒和灭藻处理。

① 装置中由NaCl 转化为NaClO 的离子方程式是_____,_____。
② 定量测定排出的海水中 Cl2 和 ClO-的含量。已知:2![]() +I2 =
+I2 =![]() +2I-。取 25.00 mL 排出的海水,加入过量 KI 溶液,然后用 a mol/LNa2S2O3 溶液滴定生成的 I2,达滴定终点时消耗Na2S2O3 溶液 b mL。该滴定操作选择的指示剂是_____,通过计算可知排出的 海水中 Cl2 和 ClO-的总物质的量浓度是_____mol/L。
+2I-。取 25.00 mL 排出的海水,加入过量 KI 溶液,然后用 a mol/LNa2S2O3 溶液滴定生成的 I2,达滴定终点时消耗Na2S2O3 溶液 b mL。该滴定操作选择的指示剂是_____,通过计算可知排出的 海水中 Cl2 和 ClO-的总物质的量浓度是_____mol/L。