题目内容
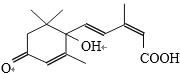
【题目】短周期五种元素A、B、C、D、E的原子序数依次增大。A、B、C的单质在常温下都呈气态,C原子最外层电子数是电子层数的3倍,C和E位于同主族。1 mol DAx与足量的A2C反应生成44.8 L(标准状况)G气体。A、B的单质依次为G、T,在密闭容器中充入一定量的G、T,一定条件下发生反应G+T→W(未配平),测得各物质的浓度如表所示。
物质 | T | G | W |
10 min时,c/(mol/L) | 0.5 | 0.8 | 0.2 |
20 min时,c/(mol/L) | 0.3 | 0.2 | 0.6 |
回答下列问题:
(1)A、B、C能组成既含离子键又含共价键的化合物,该化合物的化学式为_________。
(2)B、C、D、E的简单离子中,离子半径由大到小排序为__________(用离子符号表示)。
(3)J、L是由A、B、C、E四种元素组成的两种常见酸式盐,J、L混合可产生有刺激性气味的气体,写出这两种溶液发生反应的离子方程式__________;J、L中能使酸性高锰酸钾溶液褪色的是_______(填化学式)。
(4)B2A4C2碱性燃料电池放电效率高。该电池放电时生成B2和A2C,正极反应式为________;电池工作一段时间后,电解质溶液的pH_____(填“增大”“减小”或“不变”)。
【答案】NH4NO3或NH4NO2 S2-> N3->O2->Mg2+ HSO3-+H+=SO2↑+H2O NH4HSO3 O2+2H2O+4e-=4OH- 减小
【解析】
C原子最外层电子数是电子层数的3倍,推知C为氧,C和E位于同主族,故E为硫,A、B的单质在常温下都呈气态,且A、B、C原子序数递增,故A为氢,B为氮,1 mol DAx与足量的A2C(水)反应生成44.8 L(标准状况)G(氢气)气体,可知D为金属,DAx中氢显负价,失电子,则x=2,D显+2价,A、B、C、D、E的原子序数依次增大,故D为镁,
综上所述,A为氢,B为氮,C为氧,D为镁,E为硫,G为氢气,T为氮气,W为氨气。
(1)A为氢,B为氮,C为氧,组成的离子化合物可能为![]() 或
或![]() ,
,
故答案为:![]() 或
或![]() ;
;
(2)B为氮,C为氧,D为镁,E为硫,![]() 原子核外有三层电子半径最大,
原子核外有三层电子半径最大,![]() 、
、![]() 、
、![]() 电子层数均为两层,核外电子排布相同,质子数越多半径越小,故离子半径
电子层数均为两层,核外电子排布相同,质子数越多半径越小,故离子半径![]() ,
,
故答案为:![]() ;
;
(3) 由氢、氮、氧、硫四种元素组成的两种常见酸式盐,混合可产生有刺激性气味的气体,推测两种盐分别为![]() 和
和![]() ,产生的气体为二氧化硫,二者反应的离子方程式为:
,产生的气体为二氧化硫,二者反应的离子方程式为:![]() ,
,![]() 和
和![]() 中
中![]() 能还原高锰酸钾使其褪色,
能还原高锰酸钾使其褪色,
故答案为:![]() ;
;![]() ;
;
(4)![]() 碱性燃料电池中,正极发生还原反应,氧气生成氢氧根,电极反应式为:
碱性燃料电池中,正极发生还原反应,氧气生成氢氧根,电极反应式为:![]() ,电池总反应为:
,电池总反应为:![]() ,反应中没有消耗溶液中的氢氧根,但是产生了水,造成溶液体积增大,碱性减弱,pH减小,
,反应中没有消耗溶液中的氢氧根,但是产生了水,造成溶液体积增大,碱性减弱,pH减小,
故答案为:![]() ;减小。
;减小。

【题目】Cl2、漂白液(有效成分为 NaClO)在生产、生活中广泛用于杀菌、消毒。
(1)电解 NaCl 溶液生成Cl2的化学方程式是________________。
(2)Cl2溶于H2O、NaOH 溶液即获得氯水、漂白液。
①干燥的氯气不能漂白物质,但氯水却有漂白作用,说明起漂白作用的物质是_____。
②25℃,Cl2与H2O、NaOH 的反应如下:
反应Ⅰ | Cl2+H2O |
反应Ⅱ | Cl2+2OH- |
解释不直接使用氯水而使用漂白液做消毒剂的原因_____。
(3)家庭使用漂白液时,不宜直接接触铁制品,漂白液腐蚀铁的电极反应为:Fe-2e-=Fe2+;ClO-发生的电极反应式为____________。
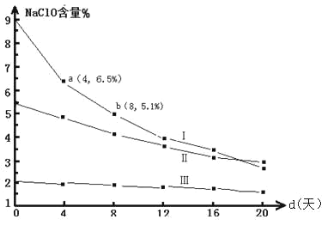
(4)研究漂白液的稳定性对其生产和保存有实际意义。30℃时,pH=11 的漂白液中NaClO 的质量百分含量随时间变化如下:
比较分解速率 v(I)、 v(II)的大小关系_____,原因是_____。