题目内容
5.氟、氯、溴、碘四种元素,下列有关它们的性质递变规律的说法不正确的是( )| A. | 单质的密度依次增大 | B. | 单质的熔点和沸点依次升高 | ||
| C. | Cl2可以从KI溶液中置换出I2 | D. | Br2可以从NaCl溶液中置换出Cl2 |
分析 A.卤素单质的密度随着原子序数增大而增大;
B.卤素单质的熔沸点随着原子序数增大而增大;
C.元素的非金属性越强,其单质的氧化性越强,氧化性较强的单质能置换出氧化性较弱的单质;
D.元素的非金属性越强,其单质的氧化性越强,氧化性较强的单质能置换出氧化性较弱的单质.
解答 解:A.从氟到碘,它们的单质都是分子晶体,其状态从气体到固态,分子之间距离逐渐减小,其单质密度从氟到碘依次增大,故A正确;
B.从氟到碘,它们的单质都是分子晶体,分子晶体的熔沸点与其相对分子质量成正比,所以其单质的熔沸点随着原子序数增大而增大,故B正确;
C.元素的非金属性越强,其单质的氧化性越强,氧化性较强的单质能置换出氧化性较弱的单质,非金属性Cl>I,所以Cl2可以从KI溶液中置换出I2,故C正确;
D..元素的非金属性越强,其单质的氧化性越强,氧化性较强的单质能置换出氧化性较弱的单质,非金属性Cl>Br,所以Br2不能从NaCl溶液中置换出Cl2,故D错误;
故选D.
点评 本题以卤族元素为载体考查同一主族元素性质递变规律,熟练掌握碱金属族、卤族、第三周期元素结构及其性质递变规律,题目难度不大.

练习册系列答案
相关题目
10.某元素的最高价含氧酸的化学式为HnXO2n,则X元素的气态氢化物的化学式为( )
| A. | XH3n | B. | HX | C. | XH2n | D. | H8-3nX |
17.下列说法正确的是( )
| A. | 若把H2S写成H3S,则违背了共价键的饱和性 | |
| B. | H3O+的存在说明共价键不应有饱和性 | |
| C. | 所有共价键都有方向性 | |
| D. | 两原子轨道发生重叠后,电子在两核间出现的概率减小 |
15.在实验室里可用如图1所示装置制取氯酸钾、次氯酸钠和探究氯水的性质.
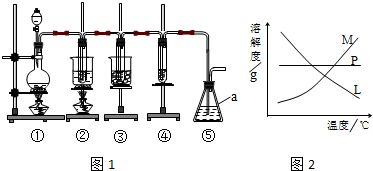
图1中:①为氯气发生装置;②的试管里盛有15mL 30% KOH溶液,并置于水浴中;③的试管里盛有15mL 8% NaOH溶液,并置于冰水浴中;④的试管里盛有紫色石蕊溶液.
请回答下列问题:
(1)仪器a的名称是锥形瓶.
(2)实验室制取氯气的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.为了除去氯气中的氯化氢气体,可在①与②之间安装盛有B(填字母代号)的净化装置.
A.碱石灰B.饱和食盐水C.浓硫酸D.饱和碳酸氢钠溶液
(3)比较制取氯酸钾和次氯酸钠的条件,二者的差异是制取温度不同、制取时碱的浓度也不同.反应完毕经冷却后,②的试管中有大量晶体析出.在图2中符合该晶体溶解度曲线的是M(填字母代号);从②的试管中分离出晶体的操作是过滤,该操作需要用到的玻璃仪器有普通漏斗、玻璃棒、烧杯.
(4)次氯酸钠中存在的化学键类型为离子键、共价键.
(5)实验中可观察到④的试管里溶液的颜色发生了如下变化,请完成下表中的空白:
(6)装置⑤的作用是吸收尾气,防止污染.

图1中:①为氯气发生装置;②的试管里盛有15mL 30% KOH溶液,并置于水浴中;③的试管里盛有15mL 8% NaOH溶液,并置于冰水浴中;④的试管里盛有紫色石蕊溶液.
请回答下列问题:
(1)仪器a的名称是锥形瓶.
(2)实验室制取氯气的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.为了除去氯气中的氯化氢气体,可在①与②之间安装盛有B(填字母代号)的净化装置.
A.碱石灰B.饱和食盐水C.浓硫酸D.饱和碳酸氢钠溶液
(3)比较制取氯酸钾和次氯酸钠的条件,二者的差异是制取温度不同、制取时碱的浓度也不同.反应完毕经冷却后,②的试管中有大量晶体析出.在图2中符合该晶体溶解度曲线的是M(填字母代号);从②的试管中分离出晶体的操作是过滤,该操作需要用到的玻璃仪器有普通漏斗、玻璃棒、烧杯.
(4)次氯酸钠中存在的化学键类型为离子键、共价键.
(5)实验中可观察到④的试管里溶液的颜色发生了如下变化,请完成下表中的空白:
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为红色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | 氯气与水反应生成的HClO将石蕊氧化为无色物质 |
| 然后溶液从无色逐渐变为浅黄绿色色 | 继续通入的氯气溶于水使溶液呈浅黄绿色 |
 ,
,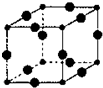 Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用.
Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用. .
.