题目内容
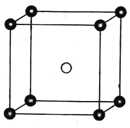
【题目】走进化学变化的微观世界,有利于进一步认识化学变化。下图是某化学变化的微观示意图,X、Y、Z分别表示不同类别的原子,据图回答问题:

反应前 反应后
(1)该化学反应中生成物的分子个数比为______________;
(2)从微观角度分析,化学反应前后各物质的质量总和相等的原因是__________________________________________________________;
(3)该化学反应的基本类型为_________________________________;
(4)由X原子构成的物质在该反应中____________(填“是”或“不是”)催化剂。
【答案】1:1化学反应前后,原子种类没有改变,数量没有增减。置换反应不是
【解析】
(1)由示意图可知反应的方程式为:X+Z2Y=XY+Z2,则该反应中生成物的分子数之比为1:1,故答案为:1:1;(2)化学反应前后各物质的质量总和相等的原因是化学反应前后,原子种类没有改变,数量没有增减,故答案为:化学反应前后,原子种类没有改变,数量没有增减;(3)该反应的反应物为单质和化合物,生成物也为单质和化合物,故为置换反应,则答案为:置换反应;(4)X是该反应的反应物,并不是催化剂,故答案为:不是。

【题目】用废Ni--MH电池正极材料可制备电子级硫酸镍晶体,其工艺流程如下图所示:
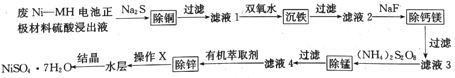
回答下列问题:
(1)废Ni-NH电池正极材料硫酸浸出液中的成分浓度如下表所示:
成分 | Ni2+ | Fe2+ | Cu2+ | Ca2+ | Mg2+ | Mn2+ | H+ | SO42- |
浓度(mol/L) | c | 0.013 | 0.0007 | 0.0013 | 0.0030 | 0.004 | 0.01 | 1.8 |
溶液中c(Ni2+)=_____mol/L(结果保留四位有效数字)。
(2)在“滤液1”中加入双氧水可将Fe2+转化为难溶的针铁矿(FeOOH),写出反应的离子方程式:___________。
(3)“滤液2”中加入NaF可将滤液中Ca2+、Mg2+转化为难溶的CaF2和MgF2。当加入过量NaF后,所得“滤液3”中c(Mg2+):c(Ca2+)=0.67,则MgF2的溶度积为______[已知Ksp(CaF2)=1.10×10-10]。
(4)“除锰”时,(NH4)2S2O8与“滤液3”中的MnSO4反应生成含锰化合物R、硫酸铵及硫酸,若氧化剂与还原剂物质的量之比为1:1,则R的化学式为_____。(填字母)
a.MnO2 b.Mn2O3 c.(NH4)2MnO4 d.Mn(OH)3
(5)“除锌”时,Zn2+与有机萃取剂(用HA表示)形成易溶于萃取剂的络合物ZnA2·2HA。
①试写出萃取时反应的离子方程式______________。
②“除锌”时、锌的萃取率随料液pH变化如右图所示:试分析pH增大时,锌的萃取率有所增大的原因是_____________________。
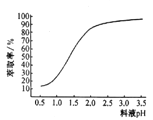
③“操作X”的名称是________________。
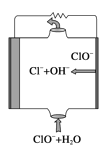
【题目】亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃)是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。制备装置如下图所示:(其中Ⅲ、Ⅳ、Ⅴ中都为浓硫酸)
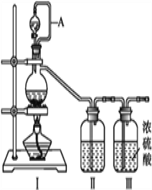

(1)用同一装置Ⅰ、Ⅱ、III分别制备纯净干燥的NO和Cl2,下表中缺少的药品是:
装置Ⅰ | 装置Ⅱ | ||
烧瓶中 | 分液漏斗中 | ||
制备纯净Cl2 | MnO2 | 浓盐酸 | ①___ |
制备纯净NO | Cu | ②___ | 水 |
(2)A的作用____________________________。
(3)NOCl的电子式_________。
(4)利用制得的NO和Cl2制备NOCl,方程式:2NO + Cl2 = 2NOCl;装置如上图所示:
①装置连接顺序为a→________(按气流自左向右方向,用小写字母表示)。
②装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是____________。
③装置Ⅷ中吸收尾气时,Cl2发生反应的离子方程式为________________。
(5)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下该混酸可生成亚硝酰氯和氯气,该反应的化学方程式为__________________。