题目内容
【题目】利用反应Cu+2FeCl3=CuCl2+2FeCl2设计成如图所示原电池,回答下列问题:
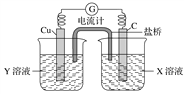
(1)写出电极反应式:正极___________________;负极_________________。
(2)图中X溶液是____________,Y溶液是____________。
(3)原电池工作时,盐桥中的________(填“阳”或“阴”)离子向X溶液方向移动。
(4)X溶液中石墨电极上发生____________(填“氧化”或“还原”)反应
【答案】 2Fe3++2e-=2Fe2+ Cu-2e-=Cu2+ FeCl3 CuCl2 阳 还原
【解析】试题分析:(1)反应Cu+2FeCl3=CuCl2+2FeCl2中,Cu失电子发生氧化反应,Fe3+得电子发生还原反应;原电池中正极发生还原反应、负极发生氧化反应。(2)根据电池总反应,正极是氯化铁发生还原反应;为防止铜发生自放电,铜与Y溶液不能反应;
(3)原电池中阳离子移向正极;(4)原电池中正极发生还原反应、负极发生氧化反应。
解析:(1)反应Cu+2FeCl3=CuCl2+2FeCl2中,Cu失电子发生氧化反应,Fe3+得电子发生还原反应;原电池中正极发生还原反应,所以C是正极,正极反应式是2Fe3++2e-=2Fe2+;负极发生氧化反应,Cu是负极,负极反应式是Cu-2e-=Cu2+;。(2)石墨是正极,正极反应是2Fe3++2e-=2Fe2+,所以图中X溶液是FeCl3,Cu是负极,Y溶液是CuCl2;(3)原电池工作时阳离子移向正极,石墨是正极,所以盐桥中的阳离子向X溶液方向移动;(4)石墨是正极,所以X溶液在石墨电极发生氧化反应。

 名校课堂系列答案
名校课堂系列答案【题目】氧化还原滴定实验与中和滴定实验类似,现用0.1000mol/L的酸性高锰酸钾溶液滴定未
知浓度的无色亚硫酸氢钠溶液,回答下列问题:
(1)滴定前润洗滴定管的操作方法__________。
(2)某同学测得的实验数据如下表
1 | 2 | 3 | 4 | |
亚硫酸氢钠溶液体积mL | 25.00 | 25.00 | 25.00 | 25.00 |
滴定管初体积mL | 0.00 | 1.02 | 1.00 | 0.80 |
滴定管末体积mL | 40.02 | 41.00 | 41.00 | 42.90 |
求待测液亚硫酸氢钠的物质的量浓度________。
(3)滴定前平视高锰酸钾液面,达滴定终点后仰视液面,则计算值比实际值___(填“偏高”或“偏低”或“不变”) 。
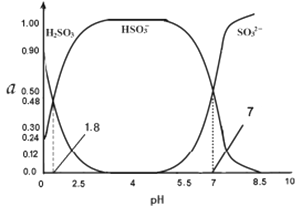
(4)常温下0.1000mol/L亚硫酸溶液中H2SO3 HSO3- SO32-三者所占物质的量分数(a)随pH变化的关系如图所示,已知lg2=0.3,则原亚硫酸氢钠溶液的pH=_______:
(5)取上述亚硫酸氢钠溶液1L,先加入氢氧化钠固体,使溶液的pH=10,(假定加固体后溶液的体积不变),则该溶液能溶解硫酸钡的物质的量n=______(已知该温度时KSp(BaSO4)=1.0×10-10 KSp(BaSO3)=1.0×10-8 )。