题目内容
【题目】2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。请回答下列问题:

(1)该反应通常用V2O5作催化剂加快反应的进行,加V2O5会使图中B点______(填“升高”或“降低”)。
(2)E的大小对该反应的反应热有无影响且理由是_______。
(3)图中A表示SO2(g)和O2(g) 的_________。图中△H的意义是__________。
(4)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物,四价钒化合物再被氧气氧化。写出该催化过程实际发生反应的化学方程式__________;V2O5对该反应进行的程度有无影响 _____________
(5)如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)=________。
【答案】降低无影响,因为反应热△H=正反应活化能-逆反应活化能,△H是个差值总能量 2molSO2(g)与 1molO2完全反应生成2molSO3(g)时,反应放出的热量V2O5+ SO2=SO3+2VO2 4VO2+O2=2 V2O5能够加快反应速率0.025 mol·L-1·min-1
【解析】
(1)该反应为放热反应,反应物的总能量高于生成物的总能量,则A为反应物能量,C为生成物能量;该反应通常用V2O5作催化剂加快反应的进行,加V2O5可改变反应的历程,降低活化能。
(2)反应热△H=正反应活化能-逆反应活化能,△H是个差值,因此E的大小对该反应的反应热无影响。
(3)图中A表示SO2(g)和O2(g) 的总能量,C为SO3(g)总能量;反应热△H意义是2molSO2(g)与 1molO2完全反应生成2molSO3(g)时,反应放出的热量。
(4)V2O5为催化加,可以参加反应,但是反应前后质量和化学性质保持不变,但可以加快反应速率,据题给信息进行书写方程式。
(5)根据速率之比等于化学计量数之比可计算得υ(O2)。
(1)该反应为放热反应,反应物的总能量高于生成物的总能量,则A为反应物能量,C为生成物能量;该反应通常用V2O5作催化剂加快反应的进行,加V2O5可改变反应的历程,降低活化能。图中B点会降低;正确答案:降低。
(2)反应热△H=正反应活化能-逆反应活化能,△H是个差值,因此E的大小对该反应的反应热无影响;正确答案:无影响,因为反应热△H=正反应活化能-逆反应活化能,△H是个差值。
(3)图中A表示反应物SO2(g)和O2(g) 的总能量;图中△H的意义是2molSO2(g)与 1molO2完全反应生成2molSO3(g)时,反应放出的热量;正确答案:总能量;2molSO2(g)与 1molO2完全反应生成2molSO3(g)时,反应放出的热量。
(4)根据题给信息可知:V2O5+ SO2=SO3+2VO2;4VO2+O2=2 V2O5;V2O5参加反应,能够加快该反应的反应速率,但是反应前后质量和化学性质保持不变,它为该反应的催化剂;正确答案:V2O5+ SO2=SO3+2VO2;4VO2+O2=2 V2O5;能够加快反应速率。
(5)如果反应速率υ(SO2)为0.05 mol·L-1·min-1,根据速率之比等于化学计量数之比可计算得υ(O2)=1/2 v(SO2)=0.025 mol·L-1·min-1;正确答案:0.025 mol·L-1·min-1。

 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案【题目】【加试题】苯甲醛(微溶于水、易溶于有机溶剂,密度约等于水的密度)在碱性条件下发生歧化反应可以制备苯甲醛(在水中溶解度不大,易溶于有机溶剂,密度约等于水的密度)、苯甲酸。反应原理如下:
2C6H5CHO+NaOH![]() C6H5CH2OH+C6H5COONa
C6H5CH2OH+C6H5COONa
C6H5COONa+HCl![]() C6H5COOH+NaCl
C6H5COOH+NaCl
相关物质物理性质如下表:
苯甲醛 | 苯甲醇 | 苯甲酸 | 苯 | |
沸点/℃ | 178 | 205 | 249 | 80 |
熔点/℃ | 26 | -15 | 122 | 5.5 |
苯甲酸在水中的溶解度 | ||
17℃ | 25℃ | 100℃ |
0.21g | 0.34g | 5.9g |
实验流程如下:

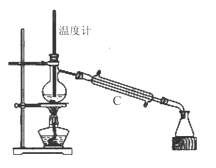
(1)第Ⅰ步需连续加热1小时(如图1),其中加热混合固定装置为画出。
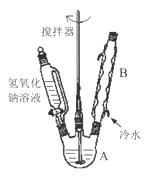
仪器A的名称为_______,若将仪器B改为仪器C,效果不如B,说明原因:_______。
(2)操作②有关分液漏斗的使用不正确的是_______
A.分液漏斗在使用之前必须检验是否漏水
B.分液漏斗内的液体不能过多,否则不利于振荡
C.充分振荡后将分液漏斗置于铁架台上静置,分层后立即打开旋塞进行分液
D.分液时待下层液体放完后立即关闭旋塞,换掉烧杯再打开旋塞使上层液体流下
(3)操作③是用沸水浴加热蒸馏,再进行操作④(如图2),收集______℃的馏分。图2中有一处明显错误,正确的应改为_____________。
(4)抽滤时(如图3)烧杯中苯甲酸晶体转入布氏漏斗时,杯壁上还粘有少量晶体,用_____冲洗杯壁上残留的晶体。抽滤完成后用少量冰水对晶体进行洗涤,洗涤应____________。
(5)用电子天平准确称取0.2440g苯甲酸于锥形瓶中加100mL蒸馏水溶解(必要时可以加热),再用0.1000mol/L的标准氢氧化钠溶液滴定,共消耗标准氢氧化钠溶液19.20mL,苯甲酸的纯度为_____%。