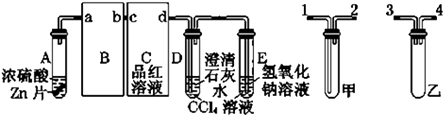
题目内容
【题目】氨氧化法制硝酸的主要反应是:4NH3(g)+5O2(g)4NO(g)+6H2O(g)
(1)①该反应的熵变△S0(填“>”、“<”或“=”).
②升高温度,反应的平衡常数K值减小,则该反应的焓变△H0(填“>”、“<”或“=”).
(2)若其他条件不变,下列关系图错误的是(选填序号).
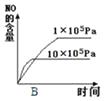


(3)在容积固定的密闭容器中发生上述反应,容器内各物质的浓度如下表:
时间/浓度/(molL﹣1) | c(NH3) | c(O2) | c(NO) | c(H2O) |
起始 | 4.0 | 5.5 | 0 | 0 |
第 2min | 3.2 | 4.5 | 0.8 | 1.2 |
第 4min | 2.0 | 3.0 | 2.0 | 3.0 |
第 6min | 2.0 | 3.0 | 2.0 | 3.0 |
①反应在第2min到第4min时,反应速率υ(O2)=;
②反应在第2min时改变了条件,改变的条件可能是 . 该条件下,反应的平衡常数K=(只写计算结果,不标单位).
【答案】
(1)>;<
(2)C
(3)0.75 mol?L﹣1?min﹣1;升高温度(或使用催化剂);3
【解析】(1)①已知4NH3(g)+5O2(g)4NO(g)+6H2O(g),反应后气体物质的量增大,所以熵增大,即△S>0;②升高温度,反应的平衡常数K值减小,说明平衡逆移,升高温度平衡逆移,则正反应为放热反应,即△H<0;(2)因4NH3(g)+5O2(g)4NO(g)+6H2O(g),△H<0,即该反应为体积增大的放热反应;A、升高温度平衡逆移,所以温度越高NH3的含量越多,与图象相符,故正确;B、增大压强平衡逆移,所以压强越大NO越小,与图象相符,故正确;C、升高温度平衡逆移,所以温度越高H2O的含量越小,与图象不相符,故错误;D、加催化剂不改变平衡,所以O2的含量不变,反应速率增大,到达平衡的时间变小,与图象相符;(3)①第 2min 到第 4min 时△c(NH3)=3.2﹣2.0=1.2molL﹣1 , 所以△c(O2)= ![]() ×1.2molL﹣1=1.5molL﹣1 , 则v(O2)=
×1.2molL﹣1=1.5molL﹣1 , 则v(O2)= ![]() =0.75 molL﹣1min﹣1;②由表中数据可知从0到2min时消耗了NH3为0.8 molL﹣1;第 2min 到第 4min 时消耗NH3为1.2molL﹣1 , 说明第 2min 以后反应速率加快,所以改变的条件为升高温度(或使用催化剂);平衡时c(NH3)=2.0 molL﹣1 , c(O2)=3.0molL﹣1 , c(NO)=2.0molL﹣1 , c(H2O)=3.0molL﹣1 , 则K=3。
=0.75 molL﹣1min﹣1;②由表中数据可知从0到2min时消耗了NH3为0.8 molL﹣1;第 2min 到第 4min 时消耗NH3为1.2molL﹣1 , 说明第 2min 以后反应速率加快,所以改变的条件为升高温度(或使用催化剂);平衡时c(NH3)=2.0 molL﹣1 , c(O2)=3.0molL﹣1 , c(NO)=2.0molL﹣1 , c(H2O)=3.0molL﹣1 , 则K=3。
【考点精析】掌握反应速率的定量表示方法和化学平衡常数的含义是解答本题的根本,需要知道反应速率的单位:mol/(L·min)或mol/(L·s) v=△c-△t;指在一定条件下的可逆反应里,正反应和逆反应的速率相等,反应混合物中各组分的浓度不变的状态.

【题目】如图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略). 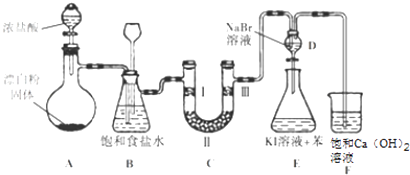
(1)装置A是氯气的发生装置,其中盛放浓盐酸的仪器名称是 , 请写出该反应相应的离子方程式: .
(2)装置B中饱和食盐水的作用是;同时装置B也是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象: .
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ处依次放入物质的组合应是(填字母编号).
编号 | Ⅰ | Ⅱ | Ⅲ |
a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
b | 干燥的有色布条 | 无水硫酸铜 | 湿润的有色布条 |
c | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘单质的氧化性.反应一段时间后,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是 , 该现象(填“能”或“不能”)说明溴单质的氧化性强于碘,原因是(用必要的文字和离子方程式回答).
(5)此装置需要改进之处是:原因是: .