题目内容
【题目】W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示。
已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强。下列说法不正确的是( )
A.对应简单离子半径:X<W
B.对应简单气态氢化物的稳定性:Y<Z
C.与Z元素同主族的元素最高价态均为+7
D.Y的氧化物能与X的最高价氧化物对应的水化物反应
【答案】C
【解析】 根据题目所给信息可推出W为O,X为Na,Y为Si,Z为Cl。A项,根据核外电子数相同的简单离子,原子序数越大,半径越小可知,对应简单离子半径:Na+<O2- , 不符合题意;B项,元素的非金属性越强,其简单气态氢化物越稳定,故HCl的稳定性强于SiH4 , 正确,不符合题意;C项,第ⅦA族元素中F元素无正价,错误,符合题意;D项,SiO2可以与NaOH溶液反应生成盐和水,正确,不符合题意。
故答案为:C
由质量数和中子数的关系确定W为O,X和Ne原子的核外电子数相差1,且半径比O大,故为Na,半导体材料为Si,半径比Si小,同周期非金属性最强,故为Cl。

 名校课堂系列答案
名校课堂系列答案【题目】氨氧化法制硝酸的主要反应是:4NH3(g)+5O2(g)4NO(g)+6H2O(g)
(1)①该反应的熵变△S0(填“>”、“<”或“=”).
②升高温度,反应的平衡常数K值减小,则该反应的焓变△H0(填“>”、“<”或“=”).
(2)若其他条件不变,下列关系图错误的是(选填序号).
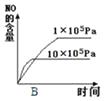


(3)在容积固定的密闭容器中发生上述反应,容器内各物质的浓度如下表:
时间/浓度/(molL﹣1) | c(NH3) | c(O2) | c(NO) | c(H2O) |
起始 | 4.0 | 5.5 | 0 | 0 |
第 2min | 3.2 | 4.5 | 0.8 | 1.2 |
第 4min | 2.0 | 3.0 | 2.0 | 3.0 |
第 6min | 2.0 | 3.0 | 2.0 | 3.0 |
①反应在第2min到第4min时,反应速率υ(O2)=;
②反应在第2min时改变了条件,改变的条件可能是 . 该条件下,反应的平衡常数K=(只写计算结果,不标单位).