题目内容
【题目】一定量的浓硫酸与足量Zn充分反应时,有SO2和H2生成.某校化学研究性学习小组对此进行研究.按图组装好实验装置,微热试管A,观察到C,D,E中均有气泡产生;随后气泡量减少,品红溶液褪色,D中先出现浑浊后浑浊消失;反应较长时间后,C,D,E中的气泡量又会明显增加. 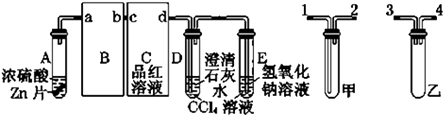
试回答:
(1)装置A中需用浓H2SO4 , 用两种简单的方法确定一瓶H2SO4一定是浓H2SO4: .
(2)从甲、乙中选择合适的装置填入B、C中,并进行正确连接,a接、接b,c接、接d;D、E两支试管中CCl4溶液的作用是 .
(3)能证明浓硫酸具有强氧化性的实验现象为;
反应较长时间后气泡量又会明显增加的原因是 .
(4)D中浑浊消失的离子方程式为 .
【答案】
(1)用火柴梗蘸取少量试液,火柴梗若立即变黑,证明是浓H2SO4(或用滴管吸取少量试液,滴加在盛少量水的试管中,若试管发热,则证明是浓H2SO4)
(2)3(或4);4(或3);2;1;防止倒吸
(3)C中品红溶液褪色;浓H2SO4变成稀H2SO4 , 与Zn反应放出H2
(4)SO2+CaSO3+H2O=Ca2++2HSO3﹣
【解析】解:(1.)浓硫酸具有脱水性,浓硫酸溶于水会放热大量热,所以鉴别方法有:用火柴梗蘸取少量试液,火柴梗若立即变黑,证明是浓H2SO4(或用滴管吸取少量试液,滴加在盛少量水的试管中,若试管发热,则证明是浓H2SO4 ,
故答案为:用火柴梗蘸取少量试液,火柴梗若立即变黑,证明是浓H2SO4(或用滴管吸取少量试液,滴加在盛少量水的试管中,若试管发热,则证明是浓H2SO4);
(2.)B的作用是防止倒吸,可将乙填入B中;C装置的作用是检验二氧化硫的漂白性,可用洗气装置,可将甲填入C中,且为长进短出,DE中的四氯化碳可以防止气体吸收时倒吸,故答案为:3(或4);4(或3); 2; 1;防止倒吸;
(3.)有二氧化硫生成能证明浓硫酸具有强氧化性,二氧化硫能使品红褪色,随着反应的进行,浓H2SO4变成稀H2SO4 , 稀硫酸与Zn反应放出H2 , 故答案为:C中品红溶液褪色;浓H2SO4变成稀H2SO4 , 与Zn反应放出H2;
(4.)过量的二氧化硫能使亚硫酸钙溶解,反应的离子方程式为:SO2+CaSO3+H2O=Ca2++2HSO3﹣ ,
故答案为:SO2+CaSO3+H2O=Ca2++2HSO3﹣ .
(1)根据浓硫酸具有脱水性或溶于水放热角度解答;(2)B的作用是防止倒吸;C装置的作用是检验二氧化硫的漂白性,可用洗气装置; 乙可防止倒吸;(3)有二氧化硫生成能证明浓硫酸具有强氧化性;随反应进行浓H2SO4变成稀H2SO4;(4)过量的二氧化硫能使亚硫酸钙溶解,所以浑浊会消失.

 阅读快车系列答案
阅读快车系列答案【题目】氨氧化法制硝酸的主要反应是:4NH3(g)+5O2(g)4NO(g)+6H2O(g)
(1)①该反应的熵变△S0(填“>”、“<”或“=”).
②升高温度,反应的平衡常数K值减小,则该反应的焓变△H0(填“>”、“<”或“=”).
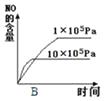
(2)若其他条件不变,下列关系图错误的是(选填序号).


(3)在容积固定的密闭容器中发生上述反应,容器内各物质的浓度如下表:
时间/浓度/(molL﹣1) | c(NH3) | c(O2) | c(NO) | c(H2O) |
起始 | 4.0 | 5.5 | 0 | 0 |
第 2min | 3.2 | 4.5 | 0.8 | 1.2 |
第 4min | 2.0 | 3.0 | 2.0 | 3.0 |
第 6min | 2.0 | 3.0 | 2.0 | 3.0 |
①反应在第2min到第4min时,反应速率υ(O2)=;
②反应在第2min时改变了条件,改变的条件可能是 . 该条件下,反应的平衡常数K=(只写计算结果,不标单位).





