题目内容
【题目】某研究小组以绿矾为原料制备化合物A[KxFe(Ⅲ)y(C2O4)znH2O],并通过如下实验步骤测定A的化学式:
步骤1:准确称取A样品4.910g,干燥脱水至恒重,残留物质量为4.370g;
步骤2:准确称取A样品4.910g置于锥形瓶中,加入足量的3.000molL﹣1的H2SO4溶液和适量蒸馏水,用0.5000molL﹣1的KMnO4溶液滴定,当MnO4﹣恰好完全被还原为Mn2+时,消耗KMnO4溶液的体积为24.00mL;
步骤3:将步骤1所得固体溶于水,加入铁粉0.2800g,恰好完全反应.
(1)①检验A中是否含有Fe2+可选用的试剂是(填字母).
a.KSCN溶液 b.KMnO4溶液 c.K3[Fe(CN)6]溶液
②证明A中含有钾元素的方法是 .
(2)步骤2中发生反应的离子方程式为 .
(3)通过计算确定化合物A的化学式(请写出计算过程).
【答案】
(1)c;用洁净的铂丝沾取A样品,在无色火焰上灼烧,透过蓝色钴玻璃观察,若能看到紫色火焰,则证明A中含有K元素
(2)2MnO4﹣+5C2O42﹣+16H+═2Mn2++10CO2↑+8H2O
(3)解:n(H2O)= ![]() =0.03000mol,n(Fe3+)=2n(Fe)=2×
=0.03000mol,n(Fe3+)=2n(Fe)=2× ![]() =0.01000mol,由方程式2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O知:n(C2O42﹣)=
=0.01000mol,由方程式2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O知:n(C2O42﹣)= ![]() ×n(KMnO4)=
×n(KMnO4)= ![]() ×0.5000mol/L×0.02400L=0.03000mol,根据离子电荷守恒:n(K+)+3n(Fe3+)=2n(C2O42﹣),n(K+)=0.03000mol,n(K+):n(Fe3+):n(C2O42﹣):n(H2O)=0.03000mol:0.01000mol:0.03000mol:0.03000mol=3:1:3:3,所以:x:y:z:n=3:1:3:3,A为K3Fe(C2O4)33H2O,
×0.5000mol/L×0.02400L=0.03000mol,根据离子电荷守恒:n(K+)+3n(Fe3+)=2n(C2O42﹣),n(K+)=0.03000mol,n(K+):n(Fe3+):n(C2O42﹣):n(H2O)=0.03000mol:0.01000mol:0.03000mol:0.03000mol=3:1:3:3,所以:x:y:z:n=3:1:3:3,A为K3Fe(C2O4)33H2O,
答:化合物A的化学式为:K3Fe(C2O4)33H2O
【解析】解:(1.)①a.KSCN溶液,遇到亚铁离子不变色,不能证明亚铁离子的存在,故a错误;
b.酸性KMnO4溶液,遇到亚铁离子褪色,可以检验亚铁离子的存在,但该溶液中含有草酸根离子,草酸根离子和高锰酸钾也能发生氧化还原反应,所以不能检验A中的亚铁离子,故b错误;
c.K3[Fe(CN)6]溶液遇到亚铁离子变蓝色,可以证明亚铁离子的存在,故c正确;
所以答案是:c;
②钾元素属于碱金属元素,通常用焰色反应进行检验,用洁净的铂丝沾取A样品,在无色火焰上灼烧,透过蓝色钴玻璃观察,若能看到紫色火焰,则证明A中含有K元素,
所以答案是:用洁净的铂丝沾取A样品,在无色火焰上灼烧,透过蓝色钴玻璃观察,若能看到紫色火焰,则证明A中含有K元素;
(2.)反应中MnO4﹣→Mn2+ , Mn元素由+7价→+2价,一得5个电子;C2O42﹣→CO2 , C元素由+3价→+4价,一个C2O42﹣失去2个电子,化合价升高值=化合价降低值=转移电子数=10,由电子守恒和原子守恒可知,反应为5C2O42﹣+2MnO4﹣+16H+=10CO2↑+2Mn2++8H2O,
所以答案是:2MnO4﹣+5C2O42﹣+16H+═2Mn2++10CO2↑+8H2O;

【题目】氨氧化法制硝酸的主要反应是:4NH3(g)+5O2(g)4NO(g)+6H2O(g)
(1)①该反应的熵变△S0(填“>”、“<”或“=”).
②升高温度,反应的平衡常数K值减小,则该反应的焓变△H0(填“>”、“<”或“=”).
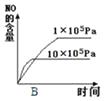
(2)若其他条件不变,下列关系图错误的是(选填序号).


(3)在容积固定的密闭容器中发生上述反应,容器内各物质的浓度如下表:
时间/浓度/(molL﹣1) | c(NH3) | c(O2) | c(NO) | c(H2O) |
起始 | 4.0 | 5.5 | 0 | 0 |
第 2min | 3.2 | 4.5 | 0.8 | 1.2 |
第 4min | 2.0 | 3.0 | 2.0 | 3.0 |
第 6min | 2.0 | 3.0 | 2.0 | 3.0 |
①反应在第2min到第4min时,反应速率υ(O2)=;
②反应在第2min时改变了条件,改变的条件可能是 . 该条件下,反应的平衡常数K=(只写计算结果,不标单位).

