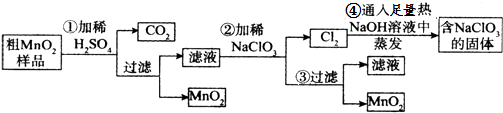
��Ŀ����
����Ŀ����ͼ��ʵ�����Ʊ�����������һϵ�����ʵ���װ�ã��г��豸���ԣ��� 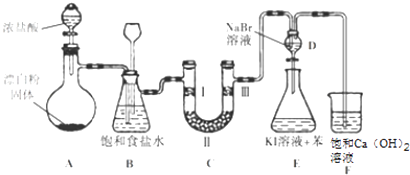
��1��װ��A�������ķ���װ�ã�����ʢ��Ũ��������������� �� ��д���÷�Ӧ��Ӧ�����ӷ���ʽ�� ��
��2��װ��B�б���ʳ��ˮ����������ͬʱװ��BҲ�ǰ�ȫƿ�����ʵ�����ʱC���Ƿ�����������д����������ʱB�е����� ��
��3��װ��C��ʵ��Ŀ������֤�����Ƿ����Ư���ԣ�Ϊ��C�Т����η������ʵ����Ӧ��������ĸ��ţ���
��� | �� | �� | �� |
a | �������ɫ���� | ��ʯ�� | ʪ�����ɫ���� |
b | �������ɫ���� | ��ˮ����ͭ | ʪ�����ɫ���� |
c | ʪ�����ɫ���� | Ũ���� | �������ɫ���� |
d | ʪ�����ɫ���� | ��ˮ�Ȼ��� | �������ɫ���� |
��4�����װ��D��E��Ŀ���DZȽ��ȡ��塢�ⵥ�ʵ������ԣ���Ӧһ��ʱ���������װ��D��������Һ����װ��E�У����۲쵽�������� �� ����������ܡ����ܡ���˵���嵥�ʵ�������ǿ�ڵ⣬ԭ�������ñ�Ҫ�����ֺ����ӷ���ʽ�ش𣩣�
��5����װ����Ҫ�Ľ�֮���ǣ�ԭ���ǣ� ��
���𰸡�
��1����Һ©����ClO��+2H++Cl��=Cl2��++H2O
��2����ȥCl2�е�HCl��B�г���©����Һ���������γ�ˮ��
��3��d
��4��E����Һ��Ϊ���㣬�ϲ㣨���㣩Ϊ�Ϻ�ɫ�����ܣ���������ǿ�����ԣ������������ܹ��������������ɵⵥ�ʣ����ӷ���ʽΪ��Cl2+2I��=I2+2Cl��
��5��F����������Ϊ�����Һ���������ʽ��٣�������������֣�Ӧ��Ϊ����������Һ����
���������⣺��1.��װ��AΪ��������װ�ã�ʢ��Ũ���������Ϊ��Һ©����
Ũ�����������Ʒ�����Ӧ�����������Ȼ��ƺ�ˮ����Ӧ�����ӷ���ʽ��ClO��+2H++Cl��=Cl2++H2O�����Դ��ǣ���Һ©����ClO��+2H++Cl��=Cl2��++H2O��
��2.��Ũ�����ӷ�����Ӧ��ȡ�������к����Ȼ��⣬װ��B�б���ʳ��ˮ�������dz�ȥCl2�е�HCl��
װ��B���ǰ�ȫƿ�����ʵ�����ʱC���Ƿ�����������������ʱB�еģ�ѹǿ����B�г���©����Һ���������γ�ˮ�������Դ��ǣ���ȥCl2�е�HCl��B�г���©����Һ���������γ�ˮ����
��3.��װ��C��ʵ��Ŀ������֤�����Ƿ����Ư���ԣ���֤�����Ƿ����Ư���ԣ�Ҫ��֤����������Ư���ԣ�ʪ�����ɫ�����У�������ˮ��Ӧ���ɴ��������Ư���ԣ�ѡ����abc�Ģ��ж��ǹ�����������ͨ��ʪ�����ɫ����������֤������Ư���ԣ�����C��I��II��III���η���ʪ�����ɫ��������ˮ�Ȼ��ơ��������ɫ����������ѡd��
���Դ��ǣ�d��
��4.����������װ��D�к��嵥�ʵ�������Һ�����ʵ⻯�غͱ���װ��E�У��嵥�ʺ͵⻯�ط�Ӧ���ɵⵥ�ʣ��ⵥ�����ڱ����Ϻ�ɫ�����۲쵽�������ǣ�E����Һ��Ϊ���㣬�ϲ㣨���㣩Ϊ�Ϻ�ɫ��
��������ǿ�����ԣ������������ܹ��������������ɵⵥ�ʣ����Ը�������˵����ķǽ�����ǿ�ڵ⣻���Դ��ǣ�E����Һ��Ϊ���㣬�ϲ㣨���㣩Ϊ�Ϻ�ɫ�����ܣ���������ǿ�����ԣ������������ܹ��������������ɵⵥ�ʣ����ӷ���ʽΪ��Cl2+2I��=I2+2Cl����
��5.����������Ϊ�����Һ���������ʽ��٣�������������֣�Ӧ��Ϊ����������Һ���գ�
���Դ��ǣ�F����������Ϊ�����Һ���������ʽ��٣�������������֣�Ӧ��Ϊ����������Һ���գ�
�����㾫����������Ŀ����֪����������������ʵ�����Ʒ������֪ʶ���Եõ�����Ĵ𰸣���Ҫ����ʵ�����Ʒ���MnO2+4HCl��Ũ��=MnCl2+Cl2��+2H2O��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ�������������������Ҫ��Ӧ�ǣ�4NH3��g��+5O2��g��4NO��g��+6H2O��g��
��1���ٸ÷�Ӧ���ر��S0�����������������=������
�������¶ȣ���Ӧ��ƽ�ⳣ��Kֵ��С����÷�Ӧ���ʱ��H0�����������������=������
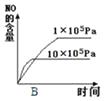
��2���������������䣬���й�ϵͼ���������ѡ����ţ���


��3�����ݻ��̶����ܱ������з���������Ӧ�������ڸ����ʵ�Ũ�����±���
ʱ��/Ũ��/��molL��1�� | c��NH3�� | c��O2�� | c��NO�� | c��H2O�� |
��ʼ | 4.0 | 5.5 | 0 | 0 |
�� 2min | 3.2 | 4.5 | 0.8 | 1.2 |
�� 4min | 2.0 | 3.0 | 2.0 | 3.0 |
�� 6min | 2.0 | 3.0 | 2.0 | 3.0 |
�ٷ�Ӧ�ڵ�2min����4minʱ����Ӧ���ʦԣ�O2��=��
�ڷ�Ӧ�ڵ�2minʱ�ı����������ı������������ �� �������£���Ӧ��ƽ�ⳣ��K=��ֻд�����������굥λ����