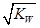题目内容
下列叙述正确的是
A.0.1mol·L-1氨水中,c (OH-)= c(NH4+)
B.10 mL 0.02mol·L-1HCl溶液与10 mL 0.02mol·L-1Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=10
C.在0.1mol·L-1CH3COONa溶液中,c(OH-)= c(CH3COOH)+c(H+)
D.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中,
c(Na+)= 2c(A2-)+c(HA-)+c(H2A)
A.0.1mol·L-1氨水中,c (OH-)= c(NH4+)
B.10 mL 0.02mol·L-1HCl溶液与10 mL 0.02mol·L-1Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=10
C.在0.1mol·L-1CH3COONa溶液中,c(OH-)= c(CH3COOH)+c(H+)
D.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中,
c(Na+)= 2c(A2-)+c(HA-)+c(H2A)
C
A.0.1mol·L-1氨水中,溶液显碱性,c (OH-)>c(H+),根据电荷守恒:c (OH-)= c(NH4+)+c(H+),c (OH-)>c(NH4+)。
B.10 mL 0.02mol·L-1HCl溶液与10 mL 0.02mol·L-1Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,很多同学错认为溶液的c (OH-)=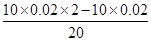 =0.01mol/L,pH=10,但忽略题目未涉及到温度,如果是非“常温下”,则计算是错误的;
=0.01mol/L,pH=10,但忽略题目未涉及到温度,如果是非“常温下”,则计算是错误的;
D.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中,电荷守恒:c(Na+)= 2c(A2-)+c(HA-)+c(OH-)。
点评:考查电解质溶液中守恒问题,离子浓度大小比较。
B.10 mL 0.02mol·L-1HCl溶液与10 mL 0.02mol·L-1Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,很多同学错认为溶液的c (OH-)=
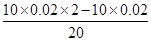 =0.01mol/L,pH=10,但忽略题目未涉及到温度,如果是非“常温下”,则计算是错误的;
=0.01mol/L,pH=10,但忽略题目未涉及到温度,如果是非“常温下”,则计算是错误的;D.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中,电荷守恒:c(Na+)= 2c(A2-)+c(HA-)+c(OH-)。
点评:考查电解质溶液中守恒问题,离子浓度大小比较。

练习册系列答案
相关题目