题目内容
(6分)某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂。请填写下列空白:
(1)终点的判断:溶液由_____________________________________________________。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是( )
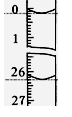
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则所用
盐酸溶液的体积为_________ml。
(4)某学生根据3次实验分别记录有关数据如表:
②依据上表数据列式计算该NaOH溶液的物质的量浓度(计算结果取4位有效数)。
(1)终点的判断:溶液由_____________________________________________________。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是( )
| A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸 |
| B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥 |
| C.酸式滴定管在滴定前有气泡,滴定后气泡消失 |
| D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数 |
盐酸溶液的体积为_________ml。

(4)某学生根据3次实验分别记录有关数据如表:
| 滴定 次数 | 待测NaOH溶液的体积/mL | 0.1000 mol/L盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 平均耗用盐酸 体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.15 | ①V=__________ |
| 第二次 | 25.00 | 0.56 | 30.30 | |
| 第三次 | 25.00 | 0.20 | 26.45 | |
(1)浅红色变为无色且半分钟内不恢复 (2)D (3) 26.10
(4)V=26.20 ml,(第二次偏差太大,舍去)
c(NaOH)=0.1000 mol/L×26.20 mL/25.00 mL=0.1048 mol/L
(4)V=26.20 ml,(第二次偏差太大,舍去)
c(NaOH)=0.1000 mol/L×26.20 mL/25.00 mL=0.1048 mol/L
略

练习册系列答案
相关题目
 H++OH-,下列叙述中正确的是
H++OH-,下列叙述中正确的是 .30mol/LCH3COOH水溶液 ⑤50毫升0.20mol/L蔗糖水溶液。以上各瓶溶液所含离子、分子总数的大小顺序是__________ _。
.30mol/LCH3COOH水溶液 ⑤50毫升0.20mol/L蔗糖水溶液。以上各瓶溶液所含离子、分子总数的大小顺序是__________ _。

 。
。