题目内容
常温下,pH=3的醋酸溶液和pH=13的氢氧化钠溶液等体积混合后(不考虑混合后溶液体积的变化),恰好完全反应。下列说法不正确的是
| A.所用醋酸溶液的浓度大于所用氢氧化钠溶液的浓度 |
| B.两溶液混合反应后的所得的混合溶液呈碱性 |
| C.原醋酸溶液中有1%的醋酸已电离 |
| D.反应后的溶液中CH3OO-与CH3COOH两种微粒的平衡浓度之和为0.05mol?L-1 |
A
醋酸溶液与氢氧化钠溶液等体积混合后恰好完全反应,由于二者是一元酸与一元碱的反应,所以醋酸与氢氧化钠溶液的浓度应该相等,A错误;恰好完全反应所得的溶液应该是醋酸钠溶液,由于醋酸根离子发生水解所以溶液呈碱性,B正确;假设体积均为1L,所以可以计算出混合前醋酸的浓度为0.1mol?L-1,根据其PH可以计算出电离出的氢离子浓度为0.001mol?L-1,醋酸的电离度为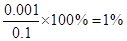 ,根据物料守恒可以得出反应前后醋酸根与醋酸分子的总的物质的量不发生变化,总的物质的量为0.1moL,等体积混合后体积变为原来的两倍,所以浓度变为原来的一半为0.05mol?L-1所以只有A错误,答案选A。
,根据物料守恒可以得出反应前后醋酸根与醋酸分子的总的物质的量不发生变化,总的物质的量为0.1moL,等体积混合后体积变为原来的两倍,所以浓度变为原来的一半为0.05mol?L-1所以只有A错误,答案选A。
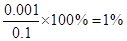 ,根据物料守恒可以得出反应前后醋酸根与醋酸分子的总的物质的量不发生变化,总的物质的量为0.1moL,等体积混合后体积变为原来的两倍,所以浓度变为原来的一半为0.05mol?L-1所以只有A错误,答案选A。
,根据物料守恒可以得出反应前后醋酸根与醋酸分子的总的物质的量不发生变化,总的物质的量为0.1moL,等体积混合后体积变为原来的两倍,所以浓度变为原来的一半为0.05mol?L-1所以只有A错误,答案选A。
练习册系列答案
 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
 质未标出)。回答下列问题:
质未标出)。回答下列问题:
 CH3OH(g)某温度下,在容积为2L的密闭容器中进行该反应,其相关数据见下图:
CH3OH(g)某温度下,在容积为2L的密闭容器中进行该反应,其相关数据见下图:

 极(填“a”或“b”)移动;b电极上发生的反应为 。
极(填“a”或“b”)移动;b电极上发生的反应为 。 达式为 (用m和V1的代数式表示)。
达式为 (用m和V1的代数式表示)。
 .30mol/LCH3COOH水溶液 ⑤50毫升0.20mol/L蔗糖水溶液。以上各瓶溶液所含离子、分子总数的大小顺序是__________ _。
.30mol/LCH3COOH水溶液 ⑤50毫升0.20mol/L蔗糖水溶液。以上各瓶溶液所含离子、分子总数的大小顺序是__________ _。

 。
。