题目内容
t℃时,水的离子积为KW,该温度下将a mol/L一元酸HA与b mol/L一元碱BOH等体积混合,若混合后溶液呈中性,下列说法一定正确的是
A.混合液中,c(H+)=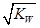 | B.混合液中pH=7 |
| C.混合液中,c(B+)>c(A-) | D.a = b |
A
分析:Kw=c(H+)?c(OH-),该温度下将amol/L一元酸HA与bmol/L一元碱BOH等体积混合,若混合后溶液呈中性,则c(H+)=c(OH-),温度不确定,则中性时溶液pH不一定为7,由于酸碱的强弱未知,则不能确定a、b的关系.
解:A.Kw=c(H+)?c(OH-),混合后溶液呈中性,则c(H+)=c(OH-),c(H+)=
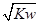 ,故A正确;
,故A正确;B.温度不确定,则中性时溶液pH不一定为7,故B错误;
C.溶液存在电荷守恒,应有:c(B+)+c(H+)=c(A-)+c(OH-),故C错误.
D.由于酸碱的强弱未知,则不能确定a、b的关系,故D错误;
故选A.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案
相关题目
 =10-2mol·L-1
=10-2mol·L-1