题目内容
(8分)在一定条件下,向体积为2 L的容器中加入2 mol O2和3 mol SO2使之反应生成SO3气体:2SO2+ O2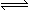 2SO3,2 min时,测得O2的物质的量为1.6 mol,则:
2SO3,2 min时,测得O2的物质的量为1.6 mol,则:
 (1)2min内,平均反应速率v(O2)= ; v(SO3)= 。
(1)2min内,平均反应速率v(O2)= ; v(SO3)= 。
 (2)2min时,SO2的浓度为
(2)2min时,SO2的浓度为
 (3)若2min时测得上述反应放出Q kJ的热量,试写出该反应的热化学方程式
(3)若2min时测得上述反应放出Q kJ的热量,试写出该反应的热化学方程式
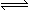 2SO3,2 min时,测得O2的物质的量为1.6 mol,则:
2SO3,2 min时,测得O2的物质的量为1.6 mol,则: (1)2min内,平均反应速率v(O2)= ; v(SO3)= 。
(1)2min内,平均反应速率v(O2)= ; v(SO3)= 。 (2)2min时,SO2的浓度为
(2)2min时,SO2的浓度为  (3)若2min时测得上述反应放出Q kJ的热量,试写出该反应的热化学方程式
(3)若2min时测得上述反应放出Q kJ的热量,试写出该反应的热化学方程式(1)0.1mol/(L·min)、0.2mol/(L·min) (2)1.1mol/L
(3)2SO2(g)+O2(g) 2SO3(g) △H=-2.5QkJ/mol
2SO3(g) △H=-2.5QkJ/mol
(3)2SO2(g)+O2(g)
 2SO3(g) △H=-2.5QkJ/mol
2SO3(g) △H=-2.5QkJ/mol(1)反应速率通常用单位时间内浓度的变化量来表示,所以氧气的反应速率为 。因为速率之比是相应的化学计量数之比,所以SO2的反应速率是氧气的2倍,即为0.2mol/(L·min)。
。因为速率之比是相应的化学计量数之比,所以SO2的反应速率是氧气的2倍,即为0.2mol/(L·min)。
(2)根据(1)可知2min内消耗0.4mol氧气,则必然消耗0.8molSO2,所以SO2的浓度为 。
。
(3)根据(1)可知2min内消耗0.4mol氧气,放出的热量是Q kJ,则消耗1mol氧气放出的热量是2.5kJ,所以热化学方程式为2SO2(g)+O2(g) 2SO3(g) △H=-2.5QkJ/mol。
2SO3(g) △H=-2.5QkJ/mol。
 。因为速率之比是相应的化学计量数之比,所以SO2的反应速率是氧气的2倍,即为0.2mol/(L·min)。
。因为速率之比是相应的化学计量数之比,所以SO2的反应速率是氧气的2倍,即为0.2mol/(L·min)。(2)根据(1)可知2min内消耗0.4mol氧气,则必然消耗0.8molSO2,所以SO2的浓度为
 。
。(3)根据(1)可知2min内消耗0.4mol氧气,放出的热量是Q kJ,则消耗1mol氧气放出的热量是2.5kJ,所以热化学方程式为2SO2(g)+O2(g)
 2SO3(g) △H=-2.5QkJ/mol。
2SO3(g) △H=-2.5QkJ/mol。
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 4C(g),
4C(g), H >0达到平衡时,改变条件重新达到平衡后体系中A的转化率增大,可行的是 __
H >0达到平衡时,改变条件重新达到平衡后体系中A的转化率增大,可行的是 __
 H2(g)+I2(g);DH>0,若降低温度,颜色加深,压强增大
H2(g)+I2(g);DH>0,若降低温度,颜色加深,压强增大 3C(g)+D(g),达到平衡状态的是( )
3C(g)+D(g),达到平衡状态的是( ) 4HCl(g)+O2 (g) ΔH>0,在一定条件下达到平衡后,分别采取下列措施,试回答:(1-4题填“增大”、“减小”、或“不变”)
4HCl(g)+O2 (g) ΔH>0,在一定条件下达到平衡后,分别采取下列措施,试回答:(1-4题填“增大”、“减小”、或“不变”) N2O4,△H<0。把烧瓶置于100℃的水中,则下列几项性质中不会改变的是 ( )
N2O4,△H<0。把烧瓶置于100℃的水中,则下列几项性质中不会改变的是 ( )