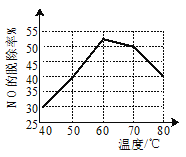
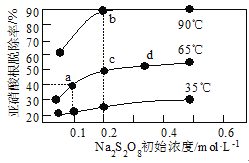
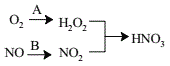题目内容
【题目】25 ℃,101 k Pa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol,辛烷的燃烧热为5518 kJ/mol。下列热化学方程式书写正确的是( )
A. 2H+(aq) +![]() (aq)+
(aq)+![]() (aq)+2OH
(aq)+2OH![]() (aq)=BaSO4(s)+2H
(aq)=BaSO4(s)+2H![]() O(l);
O(l);![]() H=
H=![]() 57.3 kJ/mol
57.3 kJ/mol
B. KOH(aq)+![]() H
H![]() SO4(aq)=
SO4(aq)=![]() K
K![]() SO4(aq)+H
SO4(aq)+H![]() O(l);
O(l);![]() H=
H=![]() 57.3kJ/mol
57.3kJ/mol
C. C8H18(l)+![]() O
O![]() (g)=8CO
(g)=8CO![]() (g)+ 9H
(g)+ 9H![]() O;
O;![]() H=
H=![]() 5518 kJ/mol
5518 kJ/mol
D. 2C8H18(g)+25O![]() (g)=16CO
(g)=16CO![]() (g)+18H
(g)+18H![]() O(l);
O(l);![]() H=
H=![]() 5518 kJ/mol
5518 kJ/mol
【答案】B
【解析】试题中和热是强酸与强碱的稀溶液发生中和反应生成1mol水时放出的热量;燃烧热是1mol可燃物完全反应生成稳定氧化物时放出的热量。
A.反应热化学方程式中生成的是2mol水,反应的中和热不是57.3kJ/mol,故A错误;
B.符合中和热的概念,故B正确;
C.反应热化学方程式中生成的水是气体,不是稳定氧化物,故C错误;
D.热化学方程式中不是1mol物质燃烧,故D错误。

练习册系列答案
相关题目