题目内容
【题目】(1)比较元素非金属性的相对强弱:![]() ________
________![]() (填“>”、“<”或“=”);用一个化学方程式说明
(填“>”、“<”或“=”);用一个化学方程式说明![]() 与
与![]() 氧化性的相对强弱________。
氧化性的相对强弱________。
(2)离子化合物![]() 可被用于治疗消化道疾病,各原子均满足8电子稳定结构。写出
可被用于治疗消化道疾病,各原子均满足8电子稳定结构。写出![]() 的电子式________。
的电子式________。
(3)半导体材料单晶硅的熔点高、硬度大,主要原因是________。
【答案】< 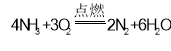
![]() 硅原子之间通过共价键结合,形成空间立体网状结构的原子晶体
硅原子之间通过共价键结合,形成空间立体网状结构的原子晶体
【解析】
(1)同周期元素从左到右非金属性增强,所以非金属性![]() <
<![]() ;氧化还原反应中,氧化剂的氧化性大于氧化产物,反应
;氧化还原反应中,氧化剂的氧化性大于氧化产物,反应![]() ,能说明
,能说明![]() 的氧化性大于
的氧化性大于![]() ;
;
(2)根据离子化合物![]() 各原子均满足8电子稳定结构,可知氧原子和氧原子之间存在非极性共价键,
各原子均满足8电子稳定结构,可知氧原子和氧原子之间存在非极性共价键,![]() 的电子式是
的电子式是![]() ;
;
(3) 硅原子之间通过共价键结合,形成空间立体网状结构的原子晶体,所以单晶硅的熔点高、硬度大。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
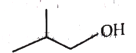
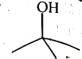
【题目】下面是丁醇的两种同分异构体,其键线式、沸点如表所:
异丁醇 | 叔丁醇 | |
键线式 |
|
|
沸点/℃ | 108 | 82.3 |
下列说法不正确的是( )
A.异丁醇分子是由异丁基、羟基构成的
B.异丁醇的核磁共振氢谱有四组峰,且面积之比是![]()
C.表中沸点数据可以说明烃基结构会明显影响有机物的物理性质
D.异丁醇、叔丁醇在一定条件下经催化氧化可分别生成异丁醛、叔丁醛