题目内容
18.把7.4g Na2CO3•10H2O和NaHCO3组成的混合物溶于水配成100mL溶液,测得溶液中钠离浓度为0.6mol/L.若把等质量的混合物加热至恒重,残留物的质量是( )| A. | 3.18 g | B. | 2.12 g | C. | 4.22 g | D. | 5.28 g |
分析 将固体混合物加热至恒重,Na2CO3•10H2O中结晶水完全失去、NaHCO3分解生成碳酸钠,所以最终残留物为碳酸钠,根据钠离子守恒可以计算出碳酸钠的物质的量,再根据m=nM计算出其质量.
解答 解:把7.4g Na2CO3•10H2O 和NaHCO3组成的混合物加热至恒重,Na2CO3•10H2O中结晶水完全失去、NaHCO3分解生成碳酸钠,所以最终残留物为碳酸钠,
根据钠离子守恒可知,n(Na2CO3)=$\frac{1}{2}$c(Na+)×V=$\frac{1}{2}$×0.6mol/L×0.1L=0.03mol,
最终得到残留物的质量为:106g/mol×0.03mol=3.18g,
故选A.
点评 本题考查了混合物反应的计算,题目难度中等,注意质量守恒定律在化学计算中的应用,试题侧重考查学生的分析理解能力,明确最终生成固体残留物的组成为解答关键.

练习册系列答案
相关题目
9.下列事实中不能证明CH3COOH是弱电解质的是( )
| A. | 常温下CH3COONa某溶液的pH=8 | |
| B. | 用CH3COOH溶液做导电实验,灯泡很暗 | |
| C. | 等pH等体积的盐酸、CH3COOH溶液分别与足量锌反应,CH3COOH放出的氢气较多 | |
| D. | 0.1mol•L-1的CH3COOH溶液中含有CH3COOH、CH3COO-、H+、OH- |
13.下列有关金属及其化合物的知识说法正确的是( )
| A. | 观察焰色反应实验为黄色火焰,则可证明该溶液中含有Na+ | |
| B. | 金属单质导电与电解质溶液导电原因是一样的 | |
| C. | 常温下浓硫酸与铁不反应,故常温下可用铁制容器贮藏贮运浓硫酸 | |
| D. | 可用Na与MgCl2溶液反应制Mg |
3.以下做法或判断合理的是( )
| A. | “洁厕灵”(浓盐酸)与“84消毒液”(次氯酸钠)可以混和使用 | |
| B. | 工业上合成氨与实验室制氨气均属于氮的固定 | |
| C. | 由于铝表面有一层致密的氧化物薄膜,所以铝制容器可用来腌制咸菜 | |
| D. | 若铝钠合金投入一定量的水中得无色溶液,则合金中n(Al)≤n(Na) |
10.63Li和73Li是锂的两种稳定同位素,在地质学和地球化学研究中有着广阔的应用前景.下列说法正确的是
( )
( )
| A. | 63Li和73Li是同一种核素 | B. | 63Li和73Li的中子数相同 | ||
| C. | 63Li和73Li的电子数相差1 | D. | 63Li和73Li的质子数相同 |
8.下列有关离子方程式表达正确的是( )
| A. | 实验室制备氢气:Cu+2H+═Cu2++H2↑ | |
| B. | NaOH溶液不能用带玻璃塞的试剂瓶保存:SiO2+2OH-═SiO32-+H2O | |
| C. | CuSO4和Ba(OH)2溶液反应:SO42-+Ba2+═BaSO4↓ | |
| D. | CO2通入氯化钙溶液中:Ca2++CO2+H2O═CaCO3↓+2H+ |


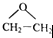 ,该反应的原子利用率为100%,其化学方程式为2CH2=CH2+O2$→_{△}^{Ag}$2
,该反应的原子利用率为100%,其化学方程式为2CH2=CH2+O2$→_{△}^{Ag}$2

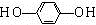 .
.