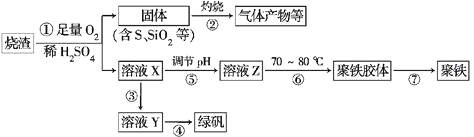
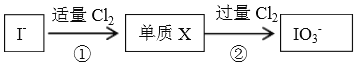
��Ŀ����
����Ŀ��CO�Ǻϳ����ء������ԭ�ϡ�
��1����100 kPa��T K�£����ȶ���������1 mol��������ʱ��Ϊ��������T Kʱ�ı�Ħ�������ʣ��÷��Ŧ�Hm0��ʾ����֪ʯī��CO�ı�ȼ���ȷֱ�Ϊ393.5 kJmol1��283.0 kJmol1 �� ��CO(g)�Ħ�Hm0=��
��2���ϳ����صķ�Ӧ��2NH3(g) + CO(g) == CO(NH2)2(g) + H2(g) ��H =81.0 kJmol1��
��T ��ʱ�������Ϊ2 L�ĺ����ܱ������У���2 molNH3��1 mol CO��Ϸ�����Ӧ��5 minʱ��NH3��ת����Ϊ80%����0��5 min�ڵ�ƽ����Ӧ����Ϊv(CO)=��
����֪��
�¶�/K | 398 | 498 | �� |
ƽ�ⳣ��(K) | 126.5 | K1 | �� |
��K1126.5(���������)�������������
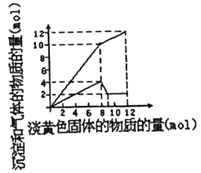
�������ֺ��º��������������ʵ���֮��Ϊ3 mol��NH3��CO�Բ�ͬ�İ�̼�Ƚ��з�Ӧ�������ͼ��ʾ��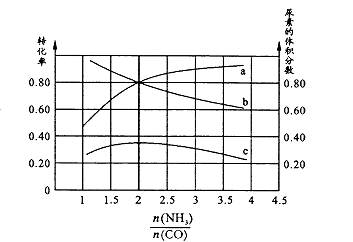
��ͼ��c��ʾƽ����ϵ�����ص������������a��ʾ��ת���ʡ�
�� ![]() =ʱ�����غ������ʱ�����ڸ÷�Ӧ������������Ӧ��������ʹƽ�������ƶ��Ĵ�ʩ��(дһ��)��
=ʱ�����غ������ʱ�����ڸ÷�Ӧ������������Ӧ��������ʹƽ�������ƶ��Ĵ�ʩ��(дһ��)��
��3��ͨ���˹�������ÿɽ�COת����HCOOH��
����֪�����£�Ũ�Ⱦ�Ϊ0.1 molL1��HCOOH��HCOONa�����ҺpH =3.7����HCOOH�ĵ��볣��Ka��ֵΪ(��֪lg2=0.3)��
���õ绯ѧ������HCOOH��ˮ����ɵ���Ⱦ����ԭ���ǵ��CoSO4��ϡ�����HCOOH�����Һ���õ�������Co3+��HCOOH������CO2��
Co3+����HCOOH�����ӷ���ʽΪ��
��������仯�����ǰ��Co2+��Ũ�Ƚ�(���������С�����䡱)��
���𰸡�
��1��?110.5 kJ?mol?1
��2��0.08 mol?L-1��min-1�������ϳ����صķ�ӦΪ���ȷ�Ӧ���¶����ߣ�ƽ�������ƶ���K��С��CO��2�������ʵ���֮��Ϊ2��1�ټ���NH3��CO
��3��2��10?4��2Co3++HCOOH==CO2��+2Co2++2H+������
���������⣺(1)̼Ԫ�ص��ȶ�������ʯī����CO(g)�Ħ�Hm0ӦΪ��ӦC��s��ʯī��+ ![]() O2��g��=CO��g�����ʱ䣬��ʯ
O2��g��=CO��g�����ʱ䣬��ʯ
ī��CO�ı�ȼ���ȿɵ��Ȼ�ѧ����ʽ:
��C��s��ʯī��+ O2��g��=CO2��g�� ��H1=-393.5 kJmol1
��C��s��ʯī��+ ![]() O2��g��=CO��g����H2=-283.0 kJmol1
O2��g��=CO��g����H2=-283.0 kJmol1
���ݸ�˹���ɣ���һ�ڵ�:
C��s��ʯī��+ ![]() O2��g��=CO��g�� ��Hm0=110.5 kJmol1 ��2����5minʱ��������ת����Ϊ80%����ӳ��NH3Ϊ2mol��80%=1.6mol����CO��Ӧ��0.8mol������c��CO��=0.4 molL-1 �� v(CO)=
O2��g��=CO��g�� ��Hm0=110.5 kJmol1 ��2����5minʱ��������ת����Ϊ80%����ӳ��NH3Ϊ2mol��80%=1.6mol����CO��Ӧ��0.8mol������c��CO��=0.4 molL-1 �� v(CO)= ![]() =0.08 molL-1��min-1����֪�ϳ����صķ�ӦΪ���ȷ�Ӧ�����¶����ߣ�ƽ�������ƶ���K��С�����498Kʱ��ƽ�ⳣ��С��398Kʱ��ƽ�ⳣ������K1��126.5����ͼ��������A���Ű�̼��
=0.08 molL-1��min-1����֪�ϳ����صķ�ӦΪ���ȷ�Ӧ�����¶����ߣ�ƽ�������ƶ���K��С�����498Kʱ��ƽ�ⳣ��С��398Kʱ��ƽ�ⳣ������K1��126.5����ͼ��������A���Ű�̼�� ![]() �������������ƽ���ƶ����ɣ���Ӧ����NH3ռ������ʱ��CO��ת������������ͼ������a��Ӧ����CO��ת���ʡ���ͼ���ֱ�ӿ�������
�������������ƽ���ƶ����ɣ���Ӧ����NH3ռ������ʱ��CO��ת������������ͼ������a��Ӧ����CO��ת���ʡ���ͼ���ֱ�ӿ������� ![]() =2ʱ�����غ�����������¶��ܼӿ췴Ӧ���ʣ���ƽ�������ƶ�����˵��Ŀ�����ƺ��º�����������ѹ���ܼӿ췴Ӧ����Ҳ��ʹƽ�������ƶ�������ѹ���ܱ�֤�����ݡ�����������ֻ�ܼӿ췴Ӧ���ʣ����ܸı�ƽ��״̬������ֻ�ܿ�������Ӧ��Ũ�ȵķ������ȽϺõľ����ʩ��:�����ʵ���֮��Ϊ2:1�ټ���NH3��CO��(3)�ٻ����Һ�д��ڵ���غ�:c��Na+��+ c��H+��= c��HCOO-��+ c��OH-��,��c��HCOO-��= c��Na+��+ c��H+��- c��OH-��=��0.1+10-3.7-10-10.3��mol/L��0.1mpl/L���������غ��c��HCOO-��+ c��HCOOH��=0.2mol/L����c��HCOOH��=0.1mol/L���������ƽ�ⳣ������ʽ��Ka=
=2ʱ�����غ�����������¶��ܼӿ췴Ӧ���ʣ���ƽ�������ƶ�����˵��Ŀ�����ƺ��º�����������ѹ���ܼӿ췴Ӧ����Ҳ��ʹƽ�������ƶ�������ѹ���ܱ�֤�����ݡ�����������ֻ�ܼӿ췴Ӧ���ʣ����ܸı�ƽ��״̬������ֻ�ܿ�������Ӧ��Ũ�ȵķ������ȽϺõľ����ʩ��:�����ʵ���֮��Ϊ2:1�ټ���NH3��CO��(3)�ٻ����Һ�д��ڵ���غ�:c��Na+��+ c��H+��= c��HCOO-��+ c��OH-��,��c��HCOO-��= c��Na+��+ c��H+��- c��OH-��=��0.1+10-3.7-10-10.3��mol/L��0.1mpl/L���������غ��c��HCOO-��+ c��HCOOH��=0.2mol/L����c��HCOOH��=0.1mol/L���������ƽ�ⳣ������ʽ��Ka= ![]() =10-3.7 �� ����֪lg2=0.3����100.3=2�������Ka=10-3.7=2��10-4����������Ϣ:Co3+��HCOOH������CO2 �� ��Co3+��HCOOH��ԭΪCo3+ �� �ɴ˿ɵ�Co3++HCOOH��CO2��+Co2+ �� ��Ӧ������������ϡ���ᣩ�½��У��ɲ�дH+����ƽ�������ӷ���ʽΪ��2Co3++HCOOH==CO2��+2Co2++2H+ �� ���ʱCo2+ת��ΪCo3+,�����Һ�����ɵ�Co3+�ֱ�HCOOH��ԭΪCo2+ �� �����������̼����ǰ��Co2+��Ũ�ȱ��ֲ��䡣
=10-3.7 �� ����֪lg2=0.3����100.3=2�������Ka=10-3.7=2��10-4����������Ϣ:Co3+��HCOOH������CO2 �� ��Co3+��HCOOH��ԭΪCo3+ �� �ɴ˿ɵ�Co3++HCOOH��CO2��+Co2+ �� ��Ӧ������������ϡ���ᣩ�½��У��ɲ�дH+����ƽ�������ӷ���ʽΪ��2Co3++HCOOH==CO2��+2Co2++2H+ �� ���ʱCo2+ת��ΪCo3+,�����Һ�����ɵ�Co3+�ֱ�HCOOH��ԭΪCo2+ �� �����������̼����ǰ��Co2+��Ũ�ȱ��ֲ��䡣
�����㾫����������Ĺؼ��������ⷴӦ�Ⱥ��ʱ�����֪ʶ�������ڻ�ѧ��Ӧ�зų������յ�������ͨ���з�Ӧ�ȣ�

 ��һ����ͬ���ɽ�����ϵ�д�
��һ����ͬ���ɽ�����ϵ�д� ������Ӧ���ϵ�д�
������Ӧ���ϵ�д�