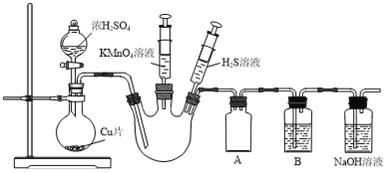
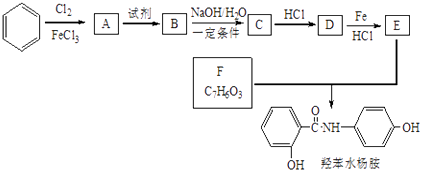
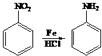
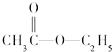题目内容
【题目】常温下,将某一元酸HA和NaOH溶液等体积混合,实验信息如下:
实验编号 | c(HA)mol·L-1 | c(NaOH)/mol·L-1 | 反应后溶液pH |
甲 | 0.1 | 0.1 | pH=9 |
乙 |
| 0.2 | pH=7 |
下列判断不正确的是( )
A. 0.1![]() 的HA溶液中由水电离出的
的HA溶液中由水电离出的![]()
B. ![]() 一定大于0.2
一定大于0.2![]()
C. 甲反应后的溶液中:HA占含A微粒总数的0.02%
D. 乙反应的溶液中:c(Na+)-)
【答案】A
【解析】甲组实验中,HA与NaOH等浓度等体积混合,恰好完全反应生成NaA,所得溶液pH=9,显碱性,则NaA为强碱弱酸盐,故HA为弱酸。A、HA为弱酸,在水溶液中不能完全电离,0.1mol/L的HA中c(H+)<0.1mol/L,则c(OH-)>10-13mol/L,溶液中OH-全部来自于水的电离,且水电离出的H+和OH-相等,所以由水电离出的c(H+)>10-13mol/L,故A错误;B、甲组实验中,酸碱等体积等浓度混合,溶液呈碱性,乙混合溶液pH=7,溶液呈中性,则酸的浓度要大于碱的浓度,故B正确;C、根据物料守恒可知,甲溶液中含A微粒总浓度=![]() =0.05mol/L,溶液的pH=9,溶液中c(OH-)=1×10-5mol/L,根据HAH++A-可知,c(HA)≈1×10-5mol/L,HA占含A微粒总数的百分比为:
=0.05mol/L,溶液的pH=9,溶液中c(OH-)=1×10-5mol/L,根据HAH++A-可知,c(HA)≈1×10-5mol/L,HA占含A微粒总数的百分比为: ![]() =0.02%.故C正确;乙溶液电荷守恒为c(OH-)+c(A-)=c(Na+)+c(H+),混合溶液PH=7,溶液呈中性,则c(OH-)=c(H+),c(A-)=c(Na+),所以c(Na+)<c(HA) + c(A-),故D正确。故选A。
=0.02%.故C正确;乙溶液电荷守恒为c(OH-)+c(A-)=c(Na+)+c(H+),混合溶液PH=7,溶液呈中性,则c(OH-)=c(H+),c(A-)=c(Na+),所以c(Na+)<c(HA) + c(A-),故D正确。故选A。

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目