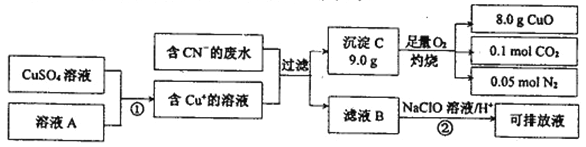
题目内容
【题目】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
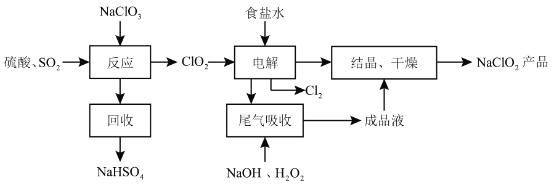
回答下列问题:
(1)NaClO2中![]() 的化合价为__________。
的化合价为__________。
(2)写出“反应”步骤中生成![]() 的化学方程式____________。
的化学方程式____________。
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去![]() 和
和![]() ,要加入的试剂分别为__________、__________。
,要加入的试剂分别为__________、__________。
(4)“尾气吸收”是吸收“电解”过程排出的少量![]() ,此吸收反应中,氧化剂与还原剂的物质的量之比为__________,该反应中氧化产物是____________。
,此吸收反应中,氧化剂与还原剂的物质的量之比为__________,该反应中氧化产物是____________。
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克![]() 的氧化能力。
的氧化能力。![]() 的有效氯含量为____________。(计算结果保留两位小数)。
的有效氯含量为____________。(计算结果保留两位小数)。
【答案】+3 2NaClO3+SO2+H2SO4=2NaHSO4+2ClO2 NaOH溶液 Na2CO3溶液 ![]() O2 1.57
O2 1.57
【解析】
(1)根据元素化合价代数和为0计算;
(2)NaClO3在硫酸作用下与SO2反应生成ClO2和一种酸式盐,二氧化硫被氧化,应生成NaHSO4;
(3)粗盐水精制时,为除去![]() 和
和![]() ,要加入的试剂是NaOH溶液和Na2CO3溶液;
,要加入的试剂是NaOH溶液和Na2CO3溶液;
(4)ClO2与H2O2反应生成NaClO2,Cl元素的化合价降低,则H2O2中O元素的化合价升高,则反应方程为:2ClO2+ H2O2+2NaOH═2NaClO2+O2↑+2H2O,结合方程式计算;
(5)每克NaClO2的物质的量![]() =
=![]() mol,依据电子转移数目相等,可知氯气的物质的量为
mol,依据电子转移数目相等,可知氯气的物质的量为![]() mol×4×
mol×4×![]() =
=![]() mol,计算得到氯气的质量。
mol,计算得到氯气的质量。
(1)在NaClO2中Na为+1价,O为-2价,根据正负化合价的代数和为0,可得Cl的化合价为+3价,
故答案为:+3;
(2)NaClO3和SO2在H2SO4酸化条件下生成ClO2,其中NaClO2是氧化剂,还原产物为NaCl,回收产物为NaHSO4,说明生成硫酸氢钠,且产生ClO2,根据电子守恒可知,此反应的化学方程式为:2NaClO3+SO2+H2SO4=2NaHSO4+2ClO2,
故答案为:2NaClO3+SO2+H2SO4=2NaHSO4+2ClO2;
(3)食盐溶液中混有Mg2+和Ca2+,可以利用过量NaOH溶液除去Mg2+,利用过量Na2CO3溶液除去Ca2+,
故答案为:NaOH溶液;Na2CO3溶液;
(4)依据图示可知,利用含过氧化氢的氢氧化钠溶液吸收ClO2,产物为ClO2-,则此反应中ClO2为氧化剂,还原产物为ClO2-,化合价从+4价降为+3价,H2O2为还原剂,氧化产物为O2,每摩尔H2O2失去2mol电子,依据电子守恒可知氧化剂和还原剂的物质的量之比为2:1,故答案为:2:1;O2;
(5)1gNaClO2的物质的量![]() =
=![]() mol,依据电子转移数目相等,NaClO2~Cl-~4e-,Cl2~2Cl-~2e-,可知氯气的物质的量为
mol,依据电子转移数目相等,NaClO2~Cl-~4e-,Cl2~2Cl-~2e-,可知氯气的物质的量为![]() mol×4×
mol×4×![]() =
=![]() mol,
mol,
则氯气的质量为![]() mol×71g/mol=1.57g,故答案为:1.57g。
mol×71g/mol=1.57g,故答案为:1.57g。

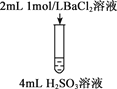
【题目】下列三组实验进行一段时间后,溶液中均有白色沉淀生成,下列结论不正确的是
实验① | 实验② | 实验③ |
|
|
|
A. 实验①中生成的沉淀是BaCO3
B. 实验①中有气体生成
C. 实验②沉淀中可能含有BaSO4
D. 实验③生成沉淀的离子方程式是:Ba2++ H2SO3===BaSO3↓+2H+