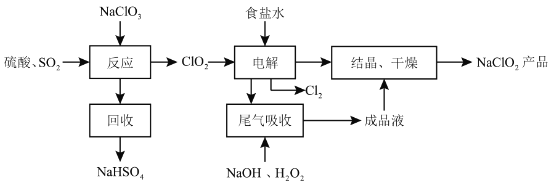
题目内容
【题目】含C、N化合物在生产、生活中有着重要的作用。请按要求回答下列问题。
N在元素周期表中的位置:______________。
元素C、N最简单气态氢化物的稳定性强弱比较(填化学式): ____________.
I.氨气应用于侯德榜制碱工艺,原理如下图所示:
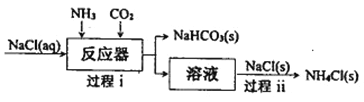
(1)过程i通入NH3和CO2的顺序是___________。
(2)过程ii有利于析出更多NH4Cl(s)的原因是_____________。
(3)制碱副产品NH4Cl可用于生产NH3和HCl。但直接加热分解NH4Cl, NH3和HCl的产率很低,原因是(用化学方程式表示)_________________。 而采用在N2氛围中,将MgO与NH4Cl混合加热至300℃,可获得高产率的NH3,该反应的化学方程式为____________。
Ⅱ.电镀工业中含CN-的废水在排放前的处理过程如下:
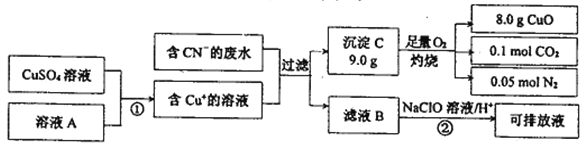
(1)溶液A具有的性质是(填“氧化性”或“还原性”) _______. C的化学式为:______。
(2)反应② 可将CN一转化为无害物质,其离子方程式为:_____________。
【答案】 第二周期VA族 CH4<NH3 先通NH3,后通CO2 NH4Cl(s)![]() NH4+(aq)+Cl-(aq),增大c(Cl-),平衡左移,促进NH4Cl析出 NH3+HCl= NH4Cl MgO+2NH4Cl
NH4+(aq)+Cl-(aq),增大c(Cl-),平衡左移,促进NH4Cl析出 NH3+HCl= NH4Cl MgO+2NH4Cl ![]() 2NH3+MgCl2+H2O↑ 还原性 CuCN 2CN-+5ClO-+2H+=N2↑+2CO2↑+5Cl-+H2O
2NH3+MgCl2+H2O↑ 还原性 CuCN 2CN-+5ClO-+2H+=N2↑+2CO2↑+5Cl-+H2O
【解析】N的原子序数是7,在元素周期表中的位置是第二周期VA族;氮元素非金属性强于碳元素,非金属性越强,氢化物越稳定,则稳定性是CH4<NH3。
I.(1)氨气极易溶于水,CO2在水中的溶解度很小,因此过程i要首先通入NH3,然后再通入CO2。(2)溶液中存在:NH4Cl(s)![]() NH4+(aq)+Cl-(aq),加入氯化钠固体,增大c(Cl-),平衡左移,从而促进NH4Cl析出。(3)加热分解NH4Cl生成的NH3和HCl冷却后又转化为氯化铵,从而得不到氨气,方程式为NH3+HCl= NH4Cl。而采用在N2氛围中,将MgO与NH4Cl混合加热至300℃,可获得高产率的NH3,根据原子守恒可知还有氯化镁和水生成,该反应的化学方程式为MgO+2NH4Cl
NH4+(aq)+Cl-(aq),加入氯化钠固体,增大c(Cl-),平衡左移,从而促进NH4Cl析出。(3)加热分解NH4Cl生成的NH3和HCl冷却后又转化为氯化铵,从而得不到氨气,方程式为NH3+HCl= NH4Cl。而采用在N2氛围中,将MgO与NH4Cl混合加热至300℃,可获得高产率的NH3,根据原子守恒可知还有氯化镁和水生成,该反应的化学方程式为MgO+2NH4Cl ![]() 2NH3↑+MgCl2+H2O。
2NH3↑+MgCl2+H2O。
Ⅱ.(1)反应中铜离子得到电子转化为亚铁离子,这说明溶液A具有还原性。9.0g沉淀C在氧气中灼烧后,产生8.0g CuO,物质的量为8g÷80g/mol=0.1mol,0.1molCO2,碳元素质量为0.1mol×12g/mol=1.2g,氮气的物质的量为0.05mol,质量是1.4g,CuO的C、N、Cu元素总质量为1.2g+1.4g+0.1mol×64g/mol=9g,等于沉淀C的质量,故C由Cu、C、N三种元素组成,且三原子物质的量之比为0.1mol:0.1mol:0.05mol×2=1:1:1,故C的化学式为CuCN。(2)反应② 可将CN一转化为无害物质,应该是氮气和CO2,则其离子方程式为2CN-+5ClO-+2H+=N2↑+2CO2↑+5Cl-+H2O。