题目内容
【题目】已知A为淡黄色固体,R是地壳中含量最多的金属元素的单质,T为生活中使用最广泛的金属单质,D是具有磁性的黑色晶体,C、F是无色无味的气体,H是白色沉淀。
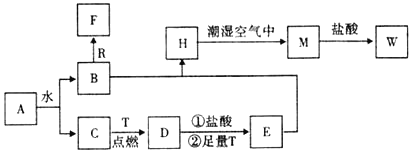
(1)物质A的化学式为_____,F化学式为____________;
(2)B和R在溶液中反应生成F的化学方程式为_____________________________;
(3)H在潮湿空气中变成M的化学方程式为_________________________________;
(4)A和水反应生成B和C的离子方程式为_________________________________;
(5)M投入盐酸中的离子方程式___________________________________________;
(6)“水玻璃”长期暴露在空气中会变质,这是因为“水玻璃”与空气中少量二氧化碳接触,生成了乳白色的凝胶状沉淀的缘故。写出反应的离子方程式____________________________;
(7)小苏打可作胃药,请写出其中和胃酸时的离子方程式____________________。
【答案】Na2O2 H2 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 4Fe(OH)2+O2+2H2O=4Fe(OH)3 2Na2O2+2H2O=4Na++4OH-+O2↑ Fe(OH)3+3H+=Fe3++3H2O CO2+SiO32-+H2O=H2SiO3↓+CO32- HCO3-+H+= H2O+ CO2↑
【解析】
根据转化关系和反应条件,A为淡黄色固体且能与水反应,所以A为Na2O2,T为生活中使用最广泛常的金属单质,则T为Fe。R是地壳中含量最多的金属,则R为Al。D是具有磁性的黑色晶体,则D为Fe3O4,C、F是无色无味的气体,H是白色沉淀,过氧化钠与水反应生成B和C,铁与C反应生成Fe3O4,所以C为O2,B为NaOH,D与盐酸反应再与铁反应生成E为FeCl2,B与E反应生成H为Fe(OH)2,H与潮湿的空气反应生成M为Fe(OH)3,M与盐酸反应生成W为FeCl3,C、F是无色无味的气体,氢氧化钠与铝反应生成F为H2,据此答题。
(1)根据上面的分析可以知道,A为Na2O2,F为H2,
因此,本题正确答案是:Na2O2;H2;
(2) B为NaOH,R为Al,铝和氢氧化钠溶液反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
因此,本题正确答案是:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(3) H为Fe(OH)2,M为Fe(OH)3,Fe(OH)2在潮湿空气中变成Fe(OH)3的反应的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,
因此,本题正确答案是: 4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(4) A为Na2O2, 过氧化钠和水反应生成氢氧化钠和氧气,离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑,
因此,本题正确答案是:2Na2O2+2H2O=4Na++4OH-+O2↑;
(5)M为Fe(OH)3,Fe(OH)3投入盐酸中的离子方程式Fe(OH)3+3H+=Fe3++3H2O,
因此,本题正确答案是:Fe(OH)3+3H+=Fe3++3H2O;
(6)“水玻璃”是硅酸钠的水溶液,由于硅酸酸性比碳酸弱,“水玻璃”与空气中少量二氧化碳接触,生成了乳白色的凝胶状沉淀为硅酸,离子方程式为CO2+SiO32-+H2O=H2SiO3↓+CO32-,
因此,本题正确答案是:CO2+SiO32-+H2O=H2SiO3↓+CO32-;
(7)小苏打为碳酸氢钠,和胃酸(盐酸)反应生成氯化钠、水和二氧化碳,反应的离子方程式为HCO3-+H+= H2O+ CO2↑,
因此,本题正确答案是:HCO3-+H+= H2O+ CO2↑。