题目内容
在18 ℃时,H2SO3的K1=1.5×10-2、K2=5.0×10-7,H2CO3的K1=1.4×10-7、K2=2.7×10-11,则下列说法中正确的是 ( )
| A.多元弱酸的酸性主要由第一步电离决定,亚硫酸的酸性弱于碳酸 |
| B.多元弱酸的酸性主要由第二步电离决定,碳酸的酸性弱于亚硫酸 |
| C.多元弱酸的酸性主要由第一步电离决定,亚硫酸的酸性强于碳酸 |
| D.多元弱酸的酸性主要由第二步电离决定,碳酸的酸性强于亚硫酸 |
C
解析

练习册系列答案
相关题目
0.1 mol/L K2CO3溶液中,若要使c(CO32-)更接近0.1 mol/L,可采取的措施是
| A.加入少量盐酸 | B.加KOH固体 | C.加水 | D.加热 |
实验:①0.1mol·L-1AgNO3溶液和0.1mol·L-1NaCl溶液等体积混合得到浊液a,过滤得到
滤液b和白色沉淀c;②向滤液b中滴加0.1mol·L-1KI溶液,出现浑浊;③向沉淀c中滴加0.1mol·L-1KI溶液,沉淀变为黄色。下列分析不正确的是:
A.浊液a中存在沉淀溶解平衡:AgCl(g) 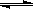 Ag+(aq)+Cl-(aq) Ag+(aq)+Cl-(aq) |
| B.滤液b中不含有Ag+ |
| C.③中颜色变化说明AgCl转化为AgI |
| D.实验可以证明AgI比AgCl更难溶 |
下列事实中不能证明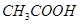 是弱电解质的是
是弱电解质的是
A.常温下某 |
B.常温下0.1mol 溶液的pH=2.8 溶液的pH=2.8 |
C. 溶液与稀盐酸反应生成 溶液与稀盐酸反应生成 |
D.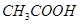 属于共价化合物 属于共价化合物 |
下列叙述正确的是( )。
| A.在常温下,无论是纯水,还是酸性、碱性或中性稀溶液中,c(H+)·c(OH-)=1×10-14 |
| B.c(H+)=1×10-7 mol·L-1的溶液一定是中性溶液 |
| C.0.2 mol·L-1 CH3COOH溶液中的c(H+)是0.1 mol·L-1 CH3COOH溶液中的c(H+)的2倍 |
| D.任何浓度的溶液都可以用pH来表示其酸碱性的强弱 |
25 ℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1 L的溶液,溶液中部分微粒与pH的关系如图所示。下列有关溶液中离子浓度关系叙述,正确的是 ( )。
| A.W点所示的溶液中:c(Na+)+c(H+)=2c(CO32—)+c(OH-)+c(Cl-) |
| B.pH=4的溶液中:c(H2CO3)+c(HCO3—)+c(CO32—)<0.1 mol·L-1 |
| C.pH=8的溶液中:c(H+)+c(H2CO3)+c(HCO3—)=c(OH-)+c(Cl-) |
| D.pH=11的溶液中:c(Na+)>c(Cl-)>c(CO32—)>c(HCO3—)>c(H2CO3) |
常温下,在10 mL 0.1 mol·L-1 Na2CO3溶液中逐滴加入0.1 mol·L-1 HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法正确的是 ( )。
| A.在0.1 mol·L-1 Na2CO3溶液中:c(Na+)+c(H+)=c(CO32—)+c(HCO3—)+ c(OH-) |
| B.当溶液的pH为7时,溶液的总体积为20 mL |
| C.在B点所示的溶液中,浓度最大的阳离子是Na+ |
| D.在A点所示的溶液中:c(CO32—)=c(HCO3—)>c(H+)>c(OH-) |
常温下pH=6的盐酸和pH=6的NH4Cl溶液,其中由水电离出的c(H+)分别为x mol/L、y mol/L,则x与y的关系是( )
| A.x=y | B.x >y | C.x=10-2y | D.x=102y |