题目内容
归纳法是高中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结:归纳正确的是
①常温下,pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,则有c (Na+) + c(H+)=c(OH-) + c(CH3COO-)
②对已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,生成物的百分含量一定增加
③常温下,AgCl在同物质的量浓度的CaCl2和NaCl溶液中的溶解度相同
④常温下,已知醋酸电离平衡常数为Ka;醋酸根水解平衡常数为Kh;水的离子积为Kw;
则有:Ka·Kh=Kw
⑤电解精炼铜时,电解质溶液中铜离子浓度不变 。
| A.①④ | B.①②④ | C.①②④⑤ | D.①②③④ |
A
解析试题分析:①、根据电荷守恒,阳离子所带正电荷总数等于阴离子所带负电荷总数,可得:c (Na+) + c(H+)=c(OH-) + c(CH3COO-),正确;②、如果分离出生成物,化学平衡向正反应方向移动,生成物的百分含量减少,错误;③、同物质的量浓度的CaCl2和NaCl溶液,CaCl2溶液中Cl?浓度大,所以AgCl在CaCl2溶液中溶解度小,错误;④、醋酸的电离方程式为:CH3COOH  CH3COO?+H+,醋酸钠水解的方程式为:CH3COO?+H2O
CH3COO?+H+,醋酸钠水解的方程式为:CH3COO?+H2O CH3COOH+OH?,两式相加得:H2O
CH3COOH+OH?,两式相加得:H2O  H++OH?,所以Ka·Kh=Kw,正确;⑤电解精炼铜时,阳极除Cu失电子,Zn、Fe、Ni也失去电子,而阴极只有Cu2+得电子生成Cu,所以电解液中Cu2+浓度减小,错误;故A项正确。
H++OH?,所以Ka·Kh=Kw,正确;⑤电解精炼铜时,阳极除Cu失电子,Zn、Fe、Ni也失去电子,而阴极只有Cu2+得电子生成Cu,所以电解液中Cu2+浓度减小,错误;故A项正确。
考点:本题考查电荷守恒、化学平衡、沉淀溶解平衡、弱电解质的电离和盐类的水解、电解精炼铜。

稀氨水中存在下述平衡: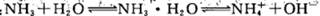 改变下列条件,能使电离程度增大的是
改变下列条件,能使电离程度增大的是
| A.加浓氨水 | B.升高温度 | C.加NH4Cl溶液 | D.加NaOH溶液 |
下列溶液中各微粒浓度关系判定不正确的是
| A.10mL 0.2 mol·L-1的氨水与l0mL 0.1 mol·L-1的盐酸充分反应混合后的溶液中,存在c(NH4+)+c(NH3·H2O)=2c(Cl-)= 0.1 mol·L-1 |
| B.已知酸性HF > CH3COOH,物质的量浓度相等的NaF与CH3COOK溶液中:c(Na+) - c(F-) >c(K+) - c(CH3COO-) |
| C.CH3COOK溶液中加入少量NaNO3固体后的碱性溶液一定有:c(K+)+c(H+)=c(CH3COO-)+c(OH-) |
| D.已知NaHS03溶液pH<7,该溶液中一定有:c(Na+)> c(HSO3-)> c(SO32-)>c(H2SO3) |
室温下,有关下列四种溶液的叙述正确的是(忽略溶液混合的体积变化)
| | ① | ② | ③ | ④ |
| pH | 12 | 12 | 2 | 2 |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A.在①、②中分别加入氯化铵晶体,两溶液的pH值均增大
B.分别将等体积的①和②加水稀释100倍,所得溶液的pH:①>②
C.把①、④两溶液等体积混合后所得溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
D.将溶液②和溶液③等体积混合,混合后所得溶液pH=7
把0.02 mol/L CH3COOH溶液和0.01 mol/L NaOH溶液以等体积混和后溶液显酸性,则混合液中微粒浓度关系正确的为
| A.c(CH3COO-)<c(Na+) |
| B.c(CH3COOH)+c(CH3COO-)="0.02" mol/L |
| C.c(CH3COOH)>c(CH3COO-) |
| D.c(OH-)+c(CH3COO-)=c(H+)+c(Na+) |
下列解释事实的反应方程式正确的是
A.氨水使酚酞溶液变红:NH4+ + H2O NH3·H2O + H+ NH3·H2O + H+ |
| B.向FeCl3溶液中加入Mg(OH)2,溶液中有红褐色沉淀生成:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+ |
| C.铅蓄电池放电时的正极反应为:PbO2+2e–+4H+=Pb2++2H2O |
| D.钢铁的析氢腐蚀与吸氧腐蚀的负极电极反应相同:Fe-3e–=Fe3+ |
在18 ℃时,H2SO3的K1=1.5×10-2、K2=5.0×10-7,H2CO3的K1=1.4×10-7、K2=2.7×10-11,则下列说法中正确的是 ( )
| A.多元弱酸的酸性主要由第一步电离决定,亚硫酸的酸性弱于碳酸 |
| B.多元弱酸的酸性主要由第二步电离决定,碳酸的酸性弱于亚硫酸 |
| C.多元弱酸的酸性主要由第一步电离决定,亚硫酸的酸性强于碳酸 |
| D.多元弱酸的酸性主要由第二步电离决定,碳酸的酸性强于亚硫酸 |
常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线见图。下列说法正确的是( )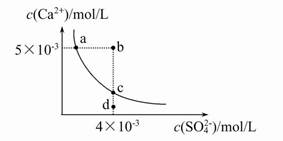
| A.CaSO4在稀硫酸中的溶解性比在纯水中的溶解性强 |
| B.b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×10-3 mol/L |
| C.d点溶液通过蒸发可以变到c点 |
| D.a点对应的Ksp等于c点对应的Ksp |
氯碱工业的产物NaOH与不同物质反应可以生成不同的盐。已知常温下,浓度均为0.1 mol·L-1的4种钠盐溶液的pH如下表:
| 溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
| pH | 11.6 | 9.7 | 10.3 | 5.2 |
下列说法中正确的是( )
A.向氯水中加入NaHCO3溶液,可以增大氯水中次氯酸的浓度
B.四种溶液中,水的电离程度最大的是NaClO
C.常温下,相同物质的量浓度的H2SO3、H2CO3、HClO溶液,pH最大的是H2SO3溶液
D.NaHSO3溶液中离子浓度大小顺序为c(Na+)>c(H+)>c(HS
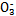 )>c(S
)>c(S )>c(OH-)
)>c(OH-)