题目内容
16. 已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增加.其中A元素原子的1s轨道上只有1个电子,B元素原子核外有三个未成对电子,B与C可形成离子化合物C3B2;D元素是地壳中含量最高的金属元素; E元素原子核外最外层只有1个电子,其余各层电子均充满.请根据以上信息,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增加.其中A元素原子的1s轨道上只有1个电子,B元素原子核外有三个未成对电子,B与C可形成离子化合物C3B2;D元素是地壳中含量最高的金属元素; E元素原子核外最外层只有1个电子,其余各层电子均充满.请根据以上信息,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)(1)写出E元素原子基态时的电子排布式:[Ar]3d104s1.B、C、D的第一电离能由小到大的顺序为Al<Mg<N.
(2)C的氯化物熔点远高于D的氯化物,理由是MgCl2为离子晶体而AlCl3为分子晶体.
(3)BA3分子中B原子的杂化轨道类型是sp3.
(4)A、B、E三种元素可形成[E(BA3)4]2+配离子,其中存在的化学键类型及相互作用有①③.
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
已知[E(BA3)4]2+具有对称较高的空间构型,若[E(BA3)4]2+中有两个BA3被Cl-取代时,得到两种不同结构的产物,则[E(BA3)4]2+的空间构型为a(填序号).
a.平面正方形 b.正四面体 c.三角锥型 d..V型
(5)B、E形成某种化合物的晶胞结构如图所示,则其化学式为Cu3N(每个球均表示1个原子).若该晶体的密度为a g/cm3,则该晶胞的体积是$\frac{206g•mo{l}^{-1}}{ag•c{m}^{-3}×6.02×1{0}^{23}mo{l}^{-1}}$ cm3(写出表达式即可).
分析 A元素原子的1s轨道上只有1个电子是氢原子,B元素原子核外有三个未成对电子是氮原子,B与C可形成离子化合物C3B2,所以C是+2价,所以C是镁,D元素是地壳中含量最高的金属元素是铝; E元素原子核外最外层只有1个电子,其余各层电子均充满,所以其基态时的电子排布式为[Ar]3d104s1,所以E是29号的铜,所以A、B、C、D、E分别是:H、N、Mg、Al、Cu,由此分析解答.
解答 解:(1)铜的基态电子排布式:[Ar]3d104s1,在元素周期表中,同一周期元素的第一电离能从左到右逐渐增大,同一主族元素的第一电离能从上到下逐渐减小,而同周期第ⅡA族和第ⅤA族元素的第一电离能比相邻元素都高,据此可判断三种元素的第一电离能的顺序为:Al<Mg<N,故答案为:[Ar]3d104s1;Al<Mg<N;
(2)因MgCl2为离子晶体而AlCl3为分子晶体,离子晶体的熔沸点远大于分子晶体的熔沸点,故答案为:MgCl2为离子晶体而AlCl3为分子晶体;
(3)氨分子中有3个σ键和一对孤对电子对,所以中心原子氮是sp3杂化,故答案为:sp3;
(4)[Cu(NH3)4]2+中铜离子与氮原子之间形成配位键,氨气分子中N原子与H原子之间形成极性键;[Cu(NH3)4]2+中的两个NH3被两个Cl-取代能得到两种不同结构的产物,[Cu(NH3)4]2+的空间构型为平面正方形,故答案为:①③;a;
(5)根据晶胞中微粒个数的分配方法计算,晶胞中含有N原子的数目为8×$\frac{1}{8}$=1,Cu原子的数目为:12×$\frac{1}{4}$=3,故化学式为Cu3N,所以该晶胞的体积=$\frac{\frac{1}{6.02×1{0}^{23}}×206g•mo{l}^{-1}}{ag/c{m}^{3}}$=$\frac{206g•mo{l}^{-1}}{ag•c{m}^{-3}×6.02×1{0}^{23}mo{l}^{-1}}$,
故答案为:Cu3N;$\frac{206g•mo{l}^{-1}}{ag•c{m}^{-3}×6.02×1{0}^{23}mo{l}^{-1}}$.
点评 本题考查物质结构和性质,涉及晶胞计算、配合物、原子核外电子排布、电离能等知识点,侧重考查学生知识运用、计算及空间想象能力,难点是晶胞计算及配位数计算,题目难度中等.

 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案| A. | 需要加热才能发生的反应可能是吸热反应也可能是放热反应 | |
| B. | 1 mol强酸与1mol强碱发生中和反应所放出的热量叫做中和热 | |
| C. | 二次电池充电时将电能转化为化学能 | |
| D. | 催化剂表面做成蜂窝状更有利于提高催化效果 |
| A. | 周期表中的各个主族都有非金属元素 | |
| B. | 周期表中的各个主族都有金属元素 | |
| C. | 周期表中的非金属元素都位于主族(除稀有气体) | |
| D. | 周期表中的非金属元素都位于短周期内 |
| A. | 碱:NaOH、KOH、Ba(OH)2、Na2CO3 | |
| B. | 氧化物:CO2、NO、SO2、H2O | |
| C. | 铵盐:NH4Cl、NH4NO3、(NH4)2SO4、NH3•H2O | |
| D. | 碱性氧化物:Na2O、CaO、Mn2O7、Al2O3 |
| A. | 1molH2O的质量是18g/mol | |
| B. | CH4的摩尔质量是16g | |
| C. | 3.01×1023个CO2分子的质量是22g | |
| D. | 标准状况下,1mol任何物质的体积均为22.4L |
 今有碱金属的两种碳酸盐和碱土金属(第二主族)的一种不溶性碳酸盐组成的混合物,取其7.560g与过量盐酸完全反应,放出CO2体积为1.344L(标况下)另取等质量的原混合物,加水搅拌,可滤出不溶性盐1.420g.
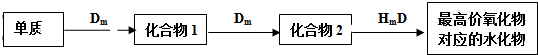
今有碱金属的两种碳酸盐和碱土金属(第二主族)的一种不溶性碳酸盐组成的混合物,取其7.560g与过量盐酸完全反应,放出CO2体积为1.344L(标况下)另取等质量的原混合物,加水搅拌,可滤出不溶性盐1.420g. 某高聚物的单体A(C11H12O2)可发生如图变化:
某高聚物的单体A(C11H12O2)可发生如图变化: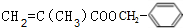 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$ .
.