题目内容
7.下列说法中不正确的是( )| A. | 需要加热才能发生的反应可能是吸热反应也可能是放热反应 | |
| B. | 1 mol强酸与1mol强碱发生中和反应所放出的热量叫做中和热 | |
| C. | 二次电池充电时将电能转化为化学能 | |
| D. | 催化剂表面做成蜂窝状更有利于提高催化效果 |
分析 A.化学反应是放热反应还是吸热反应,与反应条件无关系;
B.依据中和热的概念分析判断,强酸强碱的稀溶液完全燃烧生成1mol水放出的热量为中和热;
C.充电电池是电能转化为化学能;
D.反应物的接触面积越大其反应速率越大.
解答 解:A.化学反应是放热反应还是吸热反应,与反应条件无关系,只与反应物和生成物总能量的相对大小有关系,故A正确;
B.强酸强碱的稀溶液完全燃烧生成1mol水放出的热量为中和热,故B错误;
C.充电电池充电过程是电解原理,是电能转化为化学能,故C正确;
D.反应物的接触面积越大,反应速率越大,把铂表面做成蜂窝状是为了增大反应物的接触面积,更有利于提高催化效果,故D正确.
故选B.
点评 本题考查了化学反应能量变化的特征和中和热的定义以及电解池原理等,注意知识积累,题目较简单.

练习册系列答案
相关题目
17.下列物质中,属于纯净物的是( )
| A. | 盐酸 | B. | 液氯 | C. | 生理盐水 | D. | 漂白粉 |
15.下列物质属于硅酸盐产品的是( )
| A. | 尼龙绳 | B. | 保鲜膜 | C. | 青花瓷 | D. | 金刚石 |
19.已知34Se、35Br位于同一周期,下列关系正确的是( )
| A. | 热稳定性:HCl>H2Se>HBr | B. | 还原性:Se2->S2->Cl- | ||
| C. | 原子半径:Se>Cl>P | D. | 酸性:H2SeO4>H2SO4>H3PO4 |
 .
.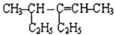 4-甲基-3-乙基-2-己烯
4-甲基-3-乙基-2-己烯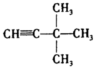 3,3-二甲基-1-丁炔.
3,3-二甲基-1-丁炔. 已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增加.其中A元素原子的1s轨道上只有1个电子,B元素原子核外有三个未成对电子,B与C可形成离子化合物C3B2;D元素是地壳中含量最高的金属元素; E元素原子核外最外层只有1个电子,其余各层电子均充满.请根据以上信息,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增加.其中A元素原子的1s轨道上只有1个电子,B元素原子核外有三个未成对电子,B与C可形成离子化合物C3B2;D元素是地壳中含量最高的金属元素; E元素原子核外最外层只有1个电子,其余各层电子均充满.请根据以上信息,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)

 +NaOH
+NaOH +NaCl+H2O(注明反应条件).
+NaCl+H2O(注明反应条件).

 .
. .
. .
.