题目内容
14.在通常条件下,下列各组物质的性质排列不正确的是( )| A. | 沸点:乙烷>戊烷>2-甲基丁烷 | B. | 熔点:Al>Na>Na和K的合金 | ||
| C. | 密度:苯<水<1,1,2,2-四溴乙烷 | D. | 热稳定性:HF>HCl>H2S |
分析 A.烷烃中碳原子个数越多其熔沸点越高,同分异构体中支链越多其熔沸点越低;
B.金属的金属键越强,其熔点越高,金属键与离子半径成反比,合金熔点高于其任一成分熔点;
C.苯的密度小于1g/mL、水的密度是1g/mL、1,1,2,2-四溴乙烷的密度大于1g/mL;
D.元素的非金属性越强,其氢化物的稳定性越强.
解答 解:A.烷烃中碳原子个数越多其熔沸点越高,同分异构体中支链越多其熔沸点越低,所以这几种烷烃的熔沸点戊烷>2-甲基丁烷>乙烷,故A错误;
B.金属的金属键越强,其熔点越高,金属键与离子半径成反比,所以金属键Na<Al,合金熔点高于其任一成分熔点,Na、K合金熔点低于Na,所以熔点Al>Na>Na和K的合金,故B正确;
C.苯的密度小于1g/mL、水的密度是1g/mL、1,1,2,2-四溴乙烷的密度大于1g/mL,所以密度苯<水<1,1,2,2-四溴乙烷,故C正确;
D.元素的非金属性越强,其氢化物的稳定性越强,非金属性F>Cl>S,则氢化物的稳定性HF>HCl>H2S,故D正确.
故选A.
点评 本题考查较综合,涉及烷烃物理性质、金属键、密度大小比较、元素周期律等知识点,侧重考查分析判断能力,知道金属键的影响因素、非金属性强弱与氢化物稳定性及其最高价氧化物的水化物酸性关系,题目难度不大.

练习册系列答案
相关题目
4.等质量的铜片,在酒精灯上加热后,分别插入下列溶液中,放置片刻后取出,铜片质量比加热前增加的是( )
| A. | 硝酸 | B. | 无水乙醇 | C. | 石灰水 | D. | 盐酸 |
5.某元素R原子最外层电子数为电子总数的$\frac{1}{3}$,该元素的氧化物可能是( )
| A. | R2O | B. | R2O2 | C. | RO2 | D. | R2O5 |
19.已知含氧酸可用通式(OH)nXOm来表示,如X是S,则m=2,n=2,则这个式子就表示H2SO4.一般而言,该式中m大的是强酸,m小的是弱酸,下列各含氧酸中酸性最强的是( )
| A. | H2SeO3 | B. | HMnO4 | C. | H3BO3 | D. | H3PO4 |
6.下列实验能证明某溶液中含铵根离子的是( )
| A. | 向溶液中加入石蕊试液后,呈蓝色 | |
| B. | 向溶液中加入酚酞试液后,呈红色 | |
| C. | 将溶液在试管中加热至沸腾,试管口放置的红色石蕊试纸变蓝色 | |
| D. | 将溶液中加入过量烧碱溶液加热至沸腾,试管口放置的红色石蕊试纸变蓝色 |
3. 在2L的恒容密闭容器中充入A(g)和B(g),发生反应:
在2L的恒容密闭容器中充入A(g)和B(g),发生反应:
A(g)+B(g)?2C(g)+D(s)△H=a kJ•mol-1,实验内容和结果分别如表和如图所示.下列说法正确的是( )
 在2L的恒容密闭容器中充入A(g)和B(g),发生反应:
在2L的恒容密闭容器中充入A(g)和B(g),发生反应:A(g)+B(g)?2C(g)+D(s)△H=a kJ•mol-1,实验内容和结果分别如表和如图所示.下列说法正确的是( )
| 实验 序号 | 温度 | 起始物质的量 | 热量 变化 | |
| A | B | |||
| Ⅰ | 600℃ | 1 mol | 3 mol | 96 kJ |
| Ⅱ | 800℃ | 1.5 mol | 0.5 mol | -- |
| A. | 实验Ⅰ中,10 min内平均速率v(B)=0.06 mol•L-1•min-1 | |
| B. | 上述方程式中a=-160 | |
| C. | 600℃时,该反应的平衡常数是0.45 | |
| D. | 向实验Ⅱ的平衡体系中再充入0.5 mol A和1.5 mol B,A的转化率增大 |
4.提纯下列物质(括号内少量杂质),所选用的除杂质试剂与分离方法正确的是( )
| 不纯物质 | 处杂试剂 | 分离方法 | |
| A | 乙酸乙酯(乙酸) | 氢氧化钠溶液 | 分液 |
| B | 乙烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| C | 乙醇(水) | 新制生石灰 | 蒸馏 |
| D | 苯(苯酚) | 浓溴水 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |

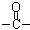 )外,含有的官能团名称是碳碳双键、酯基;
)外,含有的官能团名称是碳碳双键、酯基; .
.