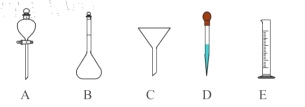题目内容
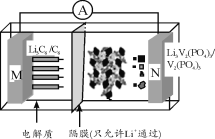
【题目】2019年诺贝尔化学奖颁给了三位为锂离子电池发展作出重要贡献的科学家。我国科学家开发的一种“磷酸钒锂/石墨锂离子电池”在4.6 V电位区电池总反应为:Li3C6+V2(PO4)3![]() 6C+Li3V2(PO4)3,下列有关说法正确的是( )
6C+Li3V2(PO4)3,下列有关说法正确的是( )
A.用Li3V2(PO4)3作负极材料
B.放电过程中,当外电路中通过0.1 mol电子时M极质量减少0.7 g
C.充电时,Li+向N极区迁移
D.充电时,N极反应为V2(PO4)3+3Li++3e-=Li3V2(PO4)3
【答案】B
【解析】
A. 根据电池放电总反应为:Li3C6+V2(PO4)3=6C+ Li3V2(PO4)3,Li3C6发生失去电子的氧化反应,M电极为负极,N电极为正极,由装置图可知Li3V2(PO4)3作正极材料,A错误;
B. 放电时,M电极为负极,反应式为Li3C6-3e-=6C+3Li+,即外电路中通过0.1 mol电子,M极有0.1 mol Li生成Li+转移到正极N极,即M减少0.1 mol Li,质量为7 g/mol×0.1 mol=0.7 g,B正确;
C. 充电时,N电极为阳极、M电极为阴极,Li+由阳极N区向阴极M极区迁移,C错误;
D. 放电时N电极为正极,充电时N电极为阳极,电极反应式为Li3V2(PO4)3-3e-= V2(PO4)3+3Li+,D错误;
故合理选项是B。

 备战中考寒假系列答案
备战中考寒假系列答案【题目】化学学习小组进行如下实验。
[探究反应速率的影响因素]设计了如下的方案并记录实验结果(忽略溶液混合体积变化)。限选试剂和仪器:0.20 mol·L-1H2C2O4溶液、0.010 mol·L-1KMnO4溶液(酸性)、蒸馏水、试管、量筒、秒表、恒温水浴槽
物理量 | V(0.20molL-1H2C2O4溶液)/mL | V(蒸馏水)/mL | V(0.010molL-1KMnO4溶液)/mL | T/℃ | 乙 |
① | 2.0 | 0 | 4.0 | 50 | |
② | 2.0 | 0 | 4.0 | 25 | |
③ | 1.0 | a | 4.0 | 25 |
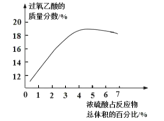
(1)上述实验①、②是探究__________对化学反应速率的影响;若上述实验②、③是探究浓度对化学反应速率的影响,则a为__________;乙是实验需要测量的物理量,则表格中“乙”应填写__________。
[测定H2C2O4·xH2O 中x值] 已知:M(H2C2O4)=90 g·mol-1
①称取1.260 g纯草酸晶体,将其酸制成 100.00 mL 水溶液为待测液;
②取25.00mL 待测液放入锥形瓶中,再加入适的稀H2SO4;
③用浓度为0.05 000 mol·L-1的KMnO4标准溶液进行滴定。
(2)请写出与滴定有关反应的离子方程式_____________________。
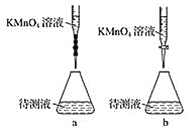
(3)某学生的滴定方式(夹持部分略去)如图,最合理的是___________(选填 a、b)。
(4)由图可知消耗KMnO4溶液体积为________________mL。

(5)滴定过程中眼睛应注视______。
(6)通过上述数据,求得x=_______。以标准KMnO4溶液滴定样品溶液的浓度,未用标准KMnO4溶液洗滴定管,引起实验结果_____________(偏大、偏小或没有影响) 。