题目内容
【题目】化学学习小组进行如下实验。
[探究反应速率的影响因素]设计了如下的方案并记录实验结果(忽略溶液混合体积变化)。限选试剂和仪器:0.20 mol·L-1H2C2O4溶液、0.010 mol·L-1KMnO4溶液(酸性)、蒸馏水、试管、量筒、秒表、恒温水浴槽
物理量 | V(0.20molL-1H2C2O4溶液)/mL | V(蒸馏水)/mL | V(0.010molL-1KMnO4溶液)/mL | T/℃ | 乙 |
① | 2.0 | 0 | 4.0 | 50 | |
② | 2.0 | 0 | 4.0 | 25 | |
③ | 1.0 | a | 4.0 | 25 |
(1)上述实验①、②是探究__________对化学反应速率的影响;若上述实验②、③是探究浓度对化学反应速率的影响,则a为__________;乙是实验需要测量的物理量,则表格中“乙”应填写__________。
[测定H2C2O4·xH2O 中x值] 已知:M(H2C2O4)=90 g·mol-1
①称取1.260 g纯草酸晶体,将其酸制成 100.00 mL 水溶液为待测液;
②取25.00mL 待测液放入锥形瓶中,再加入适的稀H2SO4;
③用浓度为0.05 000 mol·L-1的KMnO4标准溶液进行滴定。
(2)请写出与滴定有关反应的离子方程式_____________________。
(3)某学生的滴定方式(夹持部分略去)如图,最合理的是___________(选填 a、b)。
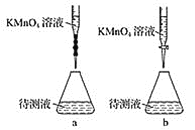
(4)由图可知消耗KMnO4溶液体积为________________mL。

(5)滴定过程中眼睛应注视______。
(6)通过上述数据,求得x=_______。以标准KMnO4溶液滴定样品溶液的浓度,未用标准KMnO4溶液洗滴定管,引起实验结果_____________(偏大、偏小或没有影响) 。
【答案】温度 1.0 溶液褪色时间/s ![]() b 20.00 锥形瓶中颜色变化 2 偏小
b 20.00 锥形瓶中颜色变化 2 偏小
【解析】
(1)当探究某一种因素对反应速率的影响时,必须保持其他影响因素一致;要探究H2C2O4溶液浓度不同对反应速率的影响,则加入的H2C2O4溶液的体积不同,但反应体积溶液的总体积需相同,故应加入蒸馏水来确保溶液的总体积均为6mL;要准确描述反应速率的快慢,必须准确测得溶液褪色时间的长短;
(2)H2C2O4溶液和酸性KMnO4溶液反应生成二氧化碳、锰离子和水;
(3)据高锰酸钾具有强氧化性选择;
(4)根据滴定管的结构、精确度以及测量原理来解答;
(5)据滴定终点的判断是溶液中颜色的变化来分析;
(6)据此![]() 离子方程式来计算;据滴定过程中眼睛应注视溶液中颜色变化,来判断滴定终点分析;根据 c(待测)=
离子方程式来计算;据滴定过程中眼睛应注视溶液中颜色变化,来判断滴定终点分析;根据 c(待测)=![]() 分析不当操作对V(标准)的影响,以此判断浓度的误差。
分析不当操作对V(标准)的影响,以此判断浓度的误差。
(1)当探究某一种因素对反应速率的影响时,必须保持其他影响因素一致,通过比较实验①②的反应条件可知,实验①②可探究温度对反应速率的影响;实验②③中的H2C2O4溶液的加入体积不同,故要探究H2C2O4溶液浓度不同对反应速率的影响,但反应体积溶液的总体积需相同,故应加入蒸馏水来确保溶液的总体积均为6.0mL,则a的值为1.0;要准确描述反应速率的快慢,必须准确测得溶液褪色时间的长短,故乙要测量的物理量是溶液褪色的时间(t溶液褪色时间/s);
故答案为:温度;1.0;溶液褪色时间/s
(2)H2C2O4溶液和酸性KMnO4溶液反应生成二氧化碳、锰离子和水,其反应的离子方程式为:![]() ,
,
故答案为:![]() ;
;
(3)高锰酸钾溶液呈强氧化性,应盛放在酸式滴定管中,
故答案为:b
(4)仪器A的名称是酸式滴定管;滴定管滴定前后读数为:0.90mL,20.90mL,消耗KMnO4溶液体积为20.90mL-0.90mL=20.00mL,
故答案为:20.00;
(5)据酸性KMnO4溶液为紫红色,滴定终点时无色变为紫红色,且半分钟不褪色为滴定终点,故眼睛应注视溶液中颜色变化,
故答案为:锥形瓶中颜色变化
(6)
m(H2C2O4)=0.0025×90=0.225g;
m(H2C2O4xH2O)=1.26×![]() =0.315g;
=0.315g;
m(H2O)=0.315-0.225=0.09g;
n(H2O)=![]() =0.005mol①
=0.005mol①
又因为n(H2C2O4)=0.0025mol,根据元素守恒即n(H2C2O4xH2O)=0.0025mol;n(H2O)=0.0025x②
联立①②得0.005=0.0025x解得x=2;
未用标准KMnO4溶液润洗滴定管,溶液被稀释,造成V(标准)偏大,n(H2C2O4)偏大,x将偏小,
故答案为:2;偏小。

 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案【题目】某工厂的电镀污泥中含有铜、铁等金属化合物。为实现资源的回收利用并有效防止环境污染,设计如下工艺流程:
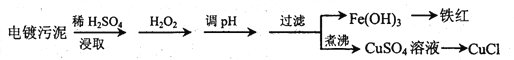
沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀的pH | 2.3 | 7.6 | 4.4 |
完全沉淀的pH | 3.2 | 9.7 | 6.4 |
(1)酸浸后加入H2O2的目的是________________,调pH的最适宜范围为________________。
(2)调pH过程中加入的试剂最好是___________。
A. NaOH B. CuO C.NH3·H2O D.HCl
(3)煮沸CuSO4溶液的原因是_________。向CuSO4溶液中加入一定量的NaCl、Na2SO3,可以生成白色的CuCl沉淀,写出该反应的化学方程式_________。
(4)过滤后的沉淀表面通常附着有一些杂质离子,为得到纯净产物,需要进行洗涤,确定沉淀洗涤干净的操作及现象是_________。
(5)称取所制备的CuCl样品0.2500g置于一定量的0.5mol·L-1FeCl3溶液中,待样品完全溶解后,加水20mL,用0.1000 mol·L-1的Ce(SO4)2溶液滴定,到达终点时消耗Ce(SO4)2溶液25.00mL。有关的化学反应为Fe3++CuCl=Fe2++Cu2++Cl-,Ce4++Fe2+=Fe3++Ce3+。计算该CuCl样品的质量分数__________。