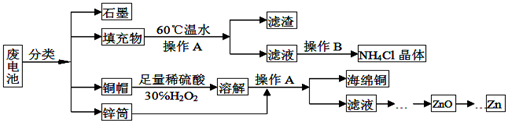
题目内容
12.在25℃时,将两个铂电极插入到一定量的Na2SO4饱和溶液中电解,通电一段时间后,在阴极逸出a mol气体,同时有Wg Na2SO4.10H2O晶体析出.若温度不变,此时剩余Na2SO4溶液的质量分数为( )| A. |  | B. |  | C. |  | D. |  |
分析 电解饱和硫酸钠溶液时,阳极上氢氧根离子放电,阴极上氢离子放电生成氢气,发生反应2H2O$\frac{\underline{\;电解\;}}{\;}$O2↑+2H2↑,电解水后,溶液中硫酸钠过饱和导致析出晶体,剩余的电解质溶液仍是饱和溶液,析出的硫酸钠晶体和电解的水组成的也是饱和溶液,根据质量分数公式计算即可.
解答 解:电解饱和硫酸钠溶液时,阳极上氢氧根离子放电,阴极上氢离子放电生成氢气,发生反应2H2O$\frac{\underline{\;电解\;}}{\;}$O2↑+2H2↑,电解水后,溶液中硫酸钠过饱和导致析出晶体,剩余的电解质溶液仍是饱和溶液,析出的硫酸钠晶体和电解的水组成的也是饱和溶液,
wg Na2SO4•10H2O硫酸钠的质量为:wg×$\frac{142}{322}$=$\frac{71w}{161}$g;
设电解水的质量为x,则:
2H2O$\frac{\underline{\;电解\;}}{\;}$O2↑+2H2↑,
36g 2mol
x amol
x=18ag,
所以饱和溶液的质量分数为:$\frac{\frac{71w}{161}}{w+18a}$×100%=$\frac{7100w}{161(w+18a)}$%,
故选A.
点评 本题以电解原理为载体考查了质量分数的计算,题目难度中等,明确电解后析出的硫酸钠晶体和电解的水组成的是饱和溶液是解本题的关键.

练习册系列答案
相关题目
3.常温下,水溶液中能大量共存的一组离子是( )
| A. | 与Al反应放出氢气的溶液中:Na+、H+、NH4+、NO3- | |
| B. | 在c(H+)=1.0×10-13,mol/L的溶液中:Na+、K+、AlO2-、CO32- | |
| C. | 澄清透明的溶液中:Fe3+、Mg2+、NO3-、S2- | |
| D. | 在pH=1的溶液中:NH4+、K+、ClO-、Cl- |
7.25℃时,电离平衡常数:
回答下列问题:
(1)下列四种离子结合质子的能力由大到小的顺序是a>b>d>c;(填编号)
a.CO32- b.ClO- c.CH3COO- d.HCO3-;
(2)下列反应不能发生的是:cd
a.CO32-+CH3COOH═CH3COO-+CO2↑+H2O
b.ClO-+CH3COOH═CH3COO-+HClO
c.CO32-+HClO═CO2↑+H2O+ClO-
d.2ClO-+CO2+H2O═CO32-+2HClO
(3)用蒸馏水稀释0.10mol•L-1的醋酸,则下列各式表示的数值随水量的增加而增大的是B
A.$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$ B.$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$
C.$\frac{c({H}^{+})}{{K}_{W}}$ D.$\frac{c({H}^{+})}{c(O{H}^{-})}$
(4)体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000mL,稀释过程pH变化 如图甲,则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的平衡常数,稀释后,HX溶液中水电离出来的c(H+)大于醋酸溶液中水电离出来的c(H+)(填“大于”、“等于”或“小于”)

(5)向20mL硫酸和盐酸的混合溶液中,逐滴加入0.05mol•L-1Ba(OH)2溶液时,生成沉淀的质量变化及由此而引起的溶液的pH的变化如图乙所示.计算:
①原混合溶液中c(H+)=0.3mol/L;c(Cl-)=0.2mol/L.
②A点的pH=1.
③将0.15mol•L-1稀硫酸V1mL与0.1mol•L-1NaOH溶液V2mL混合,所得溶液的pH为1,则V1:V2=1:1(溶液体积变化忽略不计).
| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 | |
(1)下列四种离子结合质子的能力由大到小的顺序是a>b>d>c;(填编号)
a.CO32- b.ClO- c.CH3COO- d.HCO3-;
(2)下列反应不能发生的是:cd
a.CO32-+CH3COOH═CH3COO-+CO2↑+H2O
b.ClO-+CH3COOH═CH3COO-+HClO
c.CO32-+HClO═CO2↑+H2O+ClO-
d.2ClO-+CO2+H2O═CO32-+2HClO
(3)用蒸馏水稀释0.10mol•L-1的醋酸,则下列各式表示的数值随水量的增加而增大的是B
A.$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$ B.$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$
C.$\frac{c({H}^{+})}{{K}_{W}}$ D.$\frac{c({H}^{+})}{c(O{H}^{-})}$
(4)体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000mL,稀释过程pH变化 如图甲,则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的平衡常数,稀释后,HX溶液中水电离出来的c(H+)大于醋酸溶液中水电离出来的c(H+)(填“大于”、“等于”或“小于”)

(5)向20mL硫酸和盐酸的混合溶液中,逐滴加入0.05mol•L-1Ba(OH)2溶液时,生成沉淀的质量变化及由此而引起的溶液的pH的变化如图乙所示.计算:
①原混合溶液中c(H+)=0.3mol/L;c(Cl-)=0.2mol/L.
②A点的pH=1.
③将0.15mol•L-1稀硫酸V1mL与0.1mol•L-1NaOH溶液V2mL混合,所得溶液的pH为1,则V1:V2=1:1(溶液体积变化忽略不计).
17.下列制取硝酸铜的方法最正确的是( )
| A. | Cu+HNO3(浓)→Cu(NO3)2 | |
| B. | Cu+HNO3(稀)→Cu(NO3)2 | |
| C. | Cu$→_{△}^{空气}$ CuO $\stackrel{稀硝酸}{→}$Cu(NO3)2 | |
| D. | Cu $→_{△}^{浓硫酸}$CuSO4 $\stackrel{Ba(NO_{3})_{2}}{→}$Cu(NO3)2 |
1.下列说法正确的是( )
| A. | 溶液是呈电中性的,而胶体是可以带电的 | |
| B. | 向沸水中加入FeCl3饱和溶液,继续煮沸至溶液呈红褐色时即得到Fe(OH)3胶体 | |
| C. | 清晨,阳光透过树叶间的缝隙可以产生丁达尔效应,说明空气是一种胶体 | |
| D. | 常用于区分溶液和胶体的方法是利用丁达尔效应,属于化学方法 |

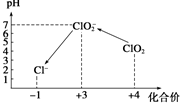 ClO2气体是一种在水处理等方面有广泛应用的高效安全消毒剂.我国从2 000年起逐步用ClO2代替氯气对饮用水进行消毒.
ClO2气体是一种在水处理等方面有广泛应用的高效安全消毒剂.我国从2 000年起逐步用ClO2代替氯气对饮用水进行消毒.