题目内容
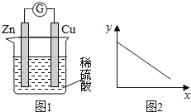
【题目】关于下列装置说法正确的是

A. 装置①中,盐桥中的Cl-移向ZnSO4溶液
B. 装置②工作一段时间后,b极附近溶液的pH增大
C. 用装置③精炼铜时,c极为粗铜
D. 装置④中电子由Zn流向Fe,装置中有Fe2+生成
【答案】A
【解析】
A、活泼金属做负极被损耗,阴离子向负极移动;
B、电解饱和食盐水时,氢离子在阴极放电,阴极区附近溶液的pH增大;
C、精炼铜时,粗铜作阳极,与电源的正极相连;
D、活泼金属做负极被损耗,不活泼金属被保护。
A项、在装置①中锌是负极,铜是正极,Cl-移向负极ZnSO4溶液,故A正确;
B项、装置②中b电极与电源正极相连,作阳极,Cl-在阳极放电,a极才是H+放电,所以装置②工作一段时间后,a极附近溶液的pH增大,故B错误;
C项、用装置③精炼铜时,粗铜作阳极,与电源的正极相连,所以用装置③精炼铜时,d极为粗铜,故C错误;
D项、装置④中锌比铁活泼,锌是负极失电子,负极反应式为Zn-2e-=Zn2+,装置中没有Fe2+生成,故D错误。

 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案【题目】含氯化合物在工农业生产和日常生活中有着广泛的用途。
(1)工业上用氯气制备漂白粉,某研究小组利用下列装置制备漂白粉。

①漂白粉的有效成分是_____________(填化学式)。漂白粉放置在空气中一段时间后会失效,原因是(写出有关反应的化学方程式)________________________。
②装置A中发生反应的化学方程式为___________________________________。
③装置B中试剂a为_________,作用是________________________________。
(2)ClO2常用于自来水的消毒、木质纸浆的漂白。已知:NaCl+3H2O![]() NaClO3+3H2↑,2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O。有关物质的熔、沸点如下表:
NaClO3+3H2↑,2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O。有关物质的熔、沸点如下表:
物质 | 熔点/℃ | 沸点/℃ |
ClO2 | -59 | 11 |
Cl2 | -107 | -34.6 |
ClO2的生产流程示意图如下:

理论上每生成1molClO2,外界至少补充X气体________ mol。从ClO2发生器中分离出ClO2可采用的方法是____________。