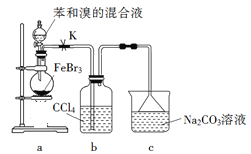
题目内容
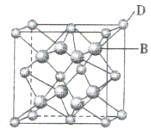
【题目】有A、B、C、D、E、F六种元素,A是周期表中原子半径最小的元素,B是电负性最大的元素,C的2p轨道中有三个未成对电子,F原子核外电子数是B 与C核外电子数之和,D是主族元素且与E同周期,E能形成红色或砖红色E2O和黑色的EO两种氧化物,D与B可形成离子化合物,其晶胞结构如图所示。请回答下列问题:
(1)C原子基态时的电子排布式为_______________,元素A、B、C、F的原子半径由大到小的顺序_________。
(2)A2F的分子空间构型为_______________,FO3分子中F原子的杂化方式______________。
(3)从图中可以看出,D 与B形成的离子化合物的化学式为__________(用元素符号表示),该离子晶体的密度为ag·cm-3,则晶胞的体积是_________(写出表达式即可,不用化简)。
(4)已知E单质的晶体为面心立方最密堆积 (在晶胞的顶点和面心均含有一个E原子),则E的晶体中E原子的配位数为________。
(5)氮化硼(BN)是一种重要的功能陶瓷材料,其晶胞结构如图所示。请回答下列问题:
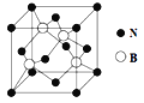
B和N相比,电负性较大的是_________,氮化硼的晶体类型______,氮化硼的晶胞中有几个氮原子_________。
【答案】1s22s22p3 或[He]2s22p3 S>N>F>H V形 sp2 CaF2 ![]() 12 N 原子晶体 4
12 N 原子晶体 4
【解析】
A是周期表中原子半径最小的元素,A为H元素;B是电负性最大的元素,B为F元素;C的2p轨道中有三个未成对电子,C的电子排布式是1s22s2sp3,C为N元素;F原子核外电子数是B 与C核外电子数之和,F是S元素;E能形成红色或砖红色E2O和黑色的EO两种氧化物,E是Cu元素;根据 D与F元素可形成离子化合物的晶胞结构图,可知D与F元素形成离子化合物化学式是DF2,D为+2价,D是主族元素且与E同周期,D是Ca元素。据此解答。
(1)C是N元素,核外有7个电子,基态时的电子排布式为1s22s22p3;电子层数越多半径越大,电子层数相同,质子数越多半径越小,元素H、F、N、S的原子半径由大到小的顺序S>N>F>H;
(2)H2S中S原子的价电子对数是4,有2对孤电子对,分子空间构型为V形,SO3分子中S原子的价电子对数是![]() ,S的杂化方式是sp2;
,S的杂化方式是sp2;
(3)根据均摊原则,Ca原子数是![]() ,F原子数是8,所以该离子化合物的化学式为CaF2,设晶胞的体积为V, ag·cm-3=
,F原子数是8,所以该离子化合物的化学式为CaF2,设晶胞的体积为V, ag·cm-3=![]() ,晶胞的体积是
,晶胞的体积是![]() ;
;
(4)根据晶胞结构可知为面心立方最密堆积,原子的配位数为12;
(5)同周期元素从左到右,电负性增大,B和N相比,电负性较大的是N,氮化硼是功能陶瓷材料,晶体类型是原子晶体,根据均摊原则,1个晶胞中氮原子有4个。

 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案【题目】I.某温度时,在一个2L的密闭容器中,X、Y、Z三种气态物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
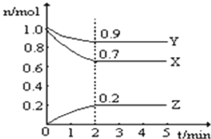
①该反应的化学方程式为____________________________。
②从开始至2min,Z的平均反应速率为________________。
③若要提高X的转化率,请提出两条合理措施_______________________________、____________________________。
II.某探究性学习小组用相同质量的锌和相同浓度的足量的稀盐酸反应得到实验数据如表所示:
实验编号 | 锌的状态 | 反应温度/℃ | 收集100mL氢气 所需时间/s |
Ⅰ | 薄片 | 15 | 200 |
Ⅱ | 薄片 | 25 | 90 |
Ⅲ | 粉末 | 25 | 10 |
①该实验的目的是探究__________、__________对锌和稀盐酸反应速率的影响;
②实验Ⅰ和Ⅱ表明__________,化学反应速率越大;
③能表明固体的表面积对反应速率有影响的实验编号是 ______ 和 ______ 。