题目内容
【题目】将一定质量的镁、铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3mol/LNaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列有关叙述中正确的是
A.加入合金的质量可能为6.4g
B.参加反应的硝酸的物质的量为0.1mol
C.沉淀完全时消耗NaOH溶液的体积为150mL
D.溶解合金时收集到NO气体的体积为2.24L
【答案】A
【解析】
将镁和铜组成的混合物加入到稀HNO3中,金属完全溶解(假设反应中还原产物只有NO)发生反应:3Mg +8 HNO3(稀)= 3Mg(NO3)2 +2NO↑+4H2O;3Cu+8 HNO3(稀)= 3Cu( NO3)2+2NO↑+4H2O,向反应后的溶液中加入过量的3mol/LNaOH溶液至沉淀完全,发生反应:Mg((NO3)2 +2NaOH = Mg((OH)2↓+2NaNO3、Cu(NO3)2 +2NaOH =Cu(OH)2↓+2NaNO3,沉淀为氢氧化镁和氢氧化铜,生成沉淀的质量比原合金的质量增加5.1g,则氢氧化镁和氢氧化铜含有氢氧根的质量为5.1g,氢氧根的物质的量为: n(OH-)=![]() =0.3mol,根据反应方程式可知,镁和铜的总的物质的量为0.15mol,以此分析解答。
=0.3mol,根据反应方程式可知,镁和铜的总的物质的量为0.15mol,以此分析解答。
A.根据反应方程式Mg((NO3)2 +2NaOH = Mg((OH)2↓+2NaNO3、Cu(NO3)2 +2NaOH =Cu(OH)2↓+2NaNO可知,镁和铜的总的物质的量为氢氧根离子物质的量的一半,即0.15mol,假定全为镁,金属质量为: 0.15mol ![]() 24g/mol=3.6g,若全为铜,则金属质量为: 0.15mol
24g/mol=3.6g,若全为铜,则金属质量为: 0.15mol ![]() 64g/mol=9.6g,两者混合金属的质量可能为6.4g,故A正确;
64g/mol=9.6g,两者混合金属的质量可能为6.4g,故A正确;
B.根据方程式可知参加反应的反应n(HNO3)=![]() n(金属)=
n(金属)=![]() =0.4mol,故B错误;
=0.4mol,故B错误;
C.反应消耗氢氧化钠的物质的量为:n( NaOH)=n(OH-)=0.3mol,则加入的氢氧化钠溶液的体积=![]() =0.1L=100mL, 故C错误;
=0.1L=100mL, 故C错误;
D.金属的物质的量为0.15mol,完全反应失去0.15mol![]() 2=0.3mol电子,根据电子转移守恒,生成一氧化氮的物质的量 n(NO)=
2=0.3mol电子,根据电子转移守恒,生成一氧化氮的物质的量 n(NO)=![]() =0.1mol,没有状态,不能确定气体的体积,故D错误;
=0.1mol,没有状态,不能确定气体的体积,故D错误;
故选:A。

 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案【题目】设空气中N2、O2的体积分数分别为0.8和0.2。在沸腾炉中将硫铁矿用空气中充分煅烧: 4FeS2+11O2![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
(1)所得气体中SO2的体积分数不超过_______%(保留一位小数)。
(2)若从接触室出来的气体中SO2、O2、N2、SO3的体积比为0.5:1:20:x,则x=_______,此时反应中SO2的转化率为_______%(保留一位小数)。
(3)在实际生产中,在接触室SO2与O2的体积比以1︰4较为适宜。若沸腾炉通入接触室的炉气中SO2、O2、N2的体积比为8:1:48,其流速为2.5m3/s, 则再往接触室里通入的空气的流速应为_______m3/s(保留一位小数;气体体积在同温同压下测定)。
(4)从吸收塔出来的气体用一定量氨水吸收,得到的铵盐产品是(NH4)2SO3和NH4HSO3的混合物。取不同质量的铵盐,分别加入x mol/L的50.00mL NaOH溶液中,经沸水浴(此温度下铵盐自身不分解)加热使氨气全部逸出,干燥后用浓硫酸完全吸收。实验数据如下:
实验次数 | 铵盐质量(g) | 浓硫酸增加的质量(g) |
第一次 | 1.570 | 0.340 |
第二次 | 3.140 | 0.680 |
第三次 | 4.710 | 0.510 |
第四次 | 6.280 | 0 |
①该铵盐中(NH4)2SO3和NH4HSO3的物质的量之比为___________。
②试求x的值:________________
【题目】某学生用NaOH标准溶液滴定未知浓度的盐酸,进项了如下实验:
Ⅰ.实验步骤:(请填空)
(1)滴定管在使用前应先检验是否漏液,然后用蒸馏水洗涤,最后用____润洗。
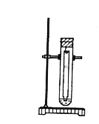
(2)将氢氧化钠溶液装入滴定管排除气泡并调节液面。如果液面初始位置如图所示,则此时的读数为____mL。
![]()
(3)取15.00mL待测盐酸装入锥形瓶中,滴加2滴酚酞作指示剂,滴定是边滴边摇动锥形瓶,眼睛应观察____(选填编号).
a.滴定管内液面的变化 b.锥形瓶内溶液颜色的变化
Ⅱ.实验记录:
实验次数 | 待测盐酸体积(mL) | 标准氢氧化钠溶液体积(mL) | ||
初读数 | 末读数 | 消耗体积 | ||
1 | 15.00 | 0.50 | 17.75 | ____ |
2 | 15.00 | 0.05 | 16.10 | 16.05 |
3 | 15.00 | 0.00 | 15.95 | 15.95 |
(4)请填写1组反应消耗的氢氧化钠溶液体积。
Ⅲ.数据处理与讨论:
(5)处理数据时应舍去误差明显过大的异常数据,余下的数据中NaOH溶液的平均消耗值是___mL。若NaOH标准溶液的浓度为0.1020mol/L,该盐酸的浓度为___mol/L。
(6)在本实验过程中,下列操作不会造成实验误差的是___(选填编号)。
a.锥形瓶中加入待测溶液后,再加少量蒸馏水
b.锥形瓶在滴定时剧烈摇动,有少量液体溅出
c.见到指示剂的颜色有变化即停止滴定