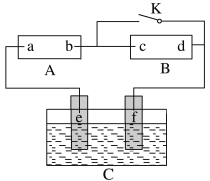
题目内容
【题目】25℃时,重水(D2O)的离子积为 1.6×10ˉ15,也可用与 pH 一样的定义来规定其酸碱度:pD=-lgc(D+),下列叙述正确的是(均为 25℃条件下)
A.重水和水两种液体,D2O 的电离度大于 H2O
B.在 100mL0.25mol·Lˉ1DCl 重水溶液中,加入 50mL0.2mol·Lˉ1NaOD 重水溶液,反应后溶液的 pD=1
C.0.01 mol·Lˉ1NaOD 重水溶液,其 pD=12
D.NH4Cl 溶于 D2O 中生成的一水合氨和水合氢离子的化学式为 NH3·D2O 和 HD2O+
【答案】B
【解析】
A.重水和水两种液体,化学性质相似,D2O 的电离度等于 H2O的电离度,故A错误;
B.根据中和反应量的关系,100mL 0.25mol·L-1 DCl和50mL 0.2mol·L-1 NaOD中和后溶液中DCl过量,剩余DCl浓度为![]() =0.1mol·L-1,则c(D+)=0.1mol·L-1,故pD=-lgc(D+)=-lg0.1=1,故B正确;
=0.1mol·L-1,则c(D+)=0.1mol·L-1,故pD=-lgc(D+)=-lg0.1=1,故B正确;
C.在1LD2O中,溶解0.01molNaOD,则溶液中c(OD-)=0.01mol·L-1,根据重水离子积常数,可知c(D+)=![]() mol·L-1=1.6×10-13mol·L-1,pD=-lgc(D+)=-lg1.6×10-13=13-lg1.6≠12,故C错误;
mol·L-1=1.6×10-13mol·L-1,pD=-lgc(D+)=-lg1.6×10-13=13-lg1.6≠12,故C错误;
D.NH4Cl 溶于 D2O 中生成的一水合氨和水合氢离子的化学式为 NH3·DHO 和 D3O+,故D错误;
故选B。

练习册系列答案
相关题目