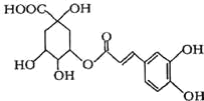
��Ŀ����
����Ŀ����̼�����������������й㷺���ڣ�Andren Dasic�������M+����������N2OΪ����������������ϩ������ȩ������ϵ������ԭѭ����ͼ��ʾ����ش��������⡣
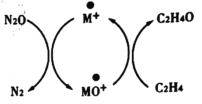
(1)��֪N2O(g)+M+(s)=N2(g)+MO+(s) ��H1=+678kJ��mol-1
MO+(s)+C2H4(g)=C2H4O(g)+M+(s) ��H2=-283kJ��mol-1
��д����M+����������N2OΪ������������ϩ������ȩ���Ȼ�ѧ����ʽ��_________
(2)��֪�ں�������I2��Һ�У���ӦCH3CHO (aq)![]() CH4 (g) +CO (g)���������У���������ӦCH3CHO (aq) +I2 (aq) ��CH3I (l) +HI (aq) +CO (g) (����Ӧ)����II��Ϊ�췴Ӧ��
CH4 (g) +CO (g)���������У���������ӦCH3CHO (aq) +I2 (aq) ��CH3I (l) +HI (aq) +CO (g) (����Ӧ)����II��Ϊ�췴Ӧ��
�پ����˷�Ӧ�������ǵ�______(����������II��)����Ӧ
����д����II����Ӧ�Ļ�ѧ����ʽ��_________
(3)����������ԭ�ӵĽ������OA��ʾ����ԭ����N2����N2O�Ľ����OA(N2) =167.4 kJ��mol-1�� ��ԭ������ϩ������ȩ�Ľ����OA (C2H4) = 473 kJ��mol-1��������÷�Ӧ������M+����ԭ�ӵĵĽ����OA (M+)��ֵӦ����________��ʹ�ô�����ʹ�÷�Ӧ�Ļ��________ (������������ ����С������������)��
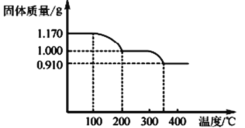
(4)ij2L�����з���: 2CO2(g)![]() 2CO (g)+O2 (g)��2molCO2�ڲ�ͬ�¶���ƽ��ֽ�������ͼ��ʾ��
2CO (g)+O2 (g)��2molCO2�ڲ�ͬ�¶���ƽ��ֽ�������ͼ��ʾ��
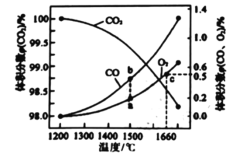
�ٺ��º��������£��ܱ�ʾ�ÿ��淴Ӧ�ﵽƽ��״̬����______(����)
A.CO���������O2��������ı�ֵ���ֲ���
B.�����ڻ��������ܶȱ��ֲ���
C.�����ڻ�������ƽ��Ħ���������ֲ���
D.������̼Ԫ�ص������������ֲ���
��ͼ��a��b��c�����ƽ�ⳣ��K(a)��K(b)��K(c)�Ĵ�С��ϵΪ_______
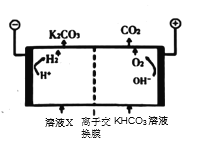
��Ϊʵ��CO2���ţ�Ŀǰ�ϳ���ķ������ø�Ũ�ȵ�K2CO3��Һ���չ�ҵ�����е�CO2������ҺX�������õ�ⷨʹK2CO3��Һ��������װ��ʾ��ͼ��ͼ���ñ�Ҫ�����ֺͻ�ѧ�������![]() ��������������ԭ��____________��
��������������ԭ��____________��
���𰸡�N2O(g)+C2H4(g)=N2(g)+C2H4O(g) H=+395kJ/mol �� CH3I(l)+HI(aq)��CH4(g)+I2(aq) 167.4kJ/mol<OA(M)<473 kJ/mol ��С C K(a)=K(b)<K(c) ![]() ���ڵ���ƽ�⣺
���ڵ���ƽ�⣺![]() H++
H++![]() ������H+�ŵ磬H+Ũ�ȼ�С��ƽ������
������H+�ŵ磬H+Ũ�ȼ�С��ƽ������
��������
(4)������Ӧ�ﵽƽ��״̬ʱ�����淴Ӧ������ȣ������ʵ�Ũ�ȡ��ٷֺ������䣬�Լ��ɴ�������һЩ��Ҳ�������仯���ݴ˷�����
�ھ�ͼ��֪�¶�����CO2�����������С��˵�������¶�ƽ�������ƶ�������ӦΪ���ȷ�Ӧ��
(1)��֪����N2O(g)+M+(s)=N2(g)+MO+(s) ��H1=+678kJ��mol-1
��MO+(s)+C2H4(g)=C2H4O(g)+M+(s) ��H2=-283kJ��mol-1
���ݸ�˹���ɢ�+�ڿɵ�N2O(g)+C2H4(g)=N2(g)+C2H4O(g) H=��H1+��H2=+678kJ��mol-1+(-283kJ��mol-1)=+395kJ/mol��
(2)������Ӧ�������巴Ӧ���ʣ����Ծ����˷�Ӧ�������ǵ�������
���ܷ�Ӧ-��������Ӧ�ɵõ�II����ӦΪCH3I(l)+HI(aq)��CH4(g)+I2(aq)��
(3)�ɴ��������û������ͼʾ��Ϣ֪������ԭ��������Ľ���������м�ֵʱ���˷�Ӧ���Է�������167.4kJmol-1<OA(M)<473kJmol-1�������ܽ��÷�Ӧ�Ļ�ܣ�
(4)��A����ʼͶ��ΪCO2�����ݷ�Ӧ����ʽ��֪�����Ƿ�ƽ�⣬��Ӧ������CO���������O2��������ı�ֵ��Ϊ2:1����A���������⣻
B���������ݣ���Ӧ����������Ϊ���壬������������ʼ�ղ��䣬�������Ƿ�ƽ�⣬������ܶ�ʼ�ղ��䣬��B���������⣻
C����������ʼ�ղ��䣬���÷�Ӧǰ������ϵ��֮�Ͳ���ȣ�Ϊƽ��ʱ����������ʵ�����䣬��ƽ����Է���������䣬���Ե��䲻��ʱ��Ӧƽ�⣬��C�������⣻
D�����������غ��֪������̼Ԫ�ص���������ʼ�ղ��䣬��D���������⣻
��������ѡC��
�ھ�ͼ��֪�¶�����CO2�����������С��˵�������¶�ƽ�������ƶ�������ӦΪ���ȷ�Ӧ�����¶�Խ�ߣ�ƽ�ⳣ��Խ��c���¶ȸ���a��b������c��ƽ�ⳣ�����a��b�����¶���ͬ��ƽ�ⳣ����ͬ����������ƽ�ⳣ����С��ϵΪK(a)=K(b)<K(c)��
��K2CO3��Һ���չ�ҵ�����е�CO2���Եõ�KHCO3��Һ����KHCO3��Һͨ�����������![]() ���ڵ���ƽ�⣺
���ڵ���ƽ�⣺![]() H++
H++![]() ������H+�ŵ磬H+Ũ�ȼ�С��ƽ�����ƣ�ʵ��K2CO3��Һ������
������H+�ŵ磬H+Ũ�ȼ�С��ƽ�����ƣ�ʵ��K2CO3��Һ������

 ��˼ά������ҵ���ټ��ִ�ѧ������ϵ�д�
��˼ά������ҵ���ټ��ִ�ѧ������ϵ�д�