题目内容
【题目】工业上以钒钛磁铁矿为原料,在炼铁的同时还可以制备钒的最高价氧化物V2O5,其主要流程如图:

已知:①![]() +2H+
+2H+![]()
![]() +H2O ②NH4VO3微溶于冷水,易溶于热水,不溶于乙醇
+H2O ②NH4VO3微溶于冷水,易溶于热水,不溶于乙醇
(l)浸取过程中提高浸取率的方法______(任写一种)
(2)钒渣中的V2O3与CaCO3混合后在空气中焙烧时转化为Ca(VO3)2同时释放出一种温室气体,写出该反应的化学方程式_____。
(3)Ca(VO3)2难溶于水但能溶于稀硫酸,试用平衡移动原理分析其原因_____,浸出液中含钒物质的化学式为_________。
(4)过滤后用乙醇代替水来洗涤沉淀的原因是______。
(5)“沉钒”得到偏钒酸铵(NH4VO3),若浸出液中c(![]() )=0.1molL-1,为使钒元素的沉降率达到98%,至少应调节c(
)=0.1molL-1,为使钒元素的沉降率达到98%,至少应调节c(![]() )为_____molL-1[已知Ksp(NH4VO3)=1.6×10-3]
)为_____molL-1[已知Ksp(NH4VO3)=1.6×10-3]
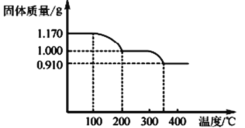
(6)煅烧NH4VO3时,固体质量随温度变化的曲线如图所示。加热到200℃时,得到的固体物质化学式为_____。
【答案】粉碎/加热/搅拌/适当提高硫酸浓度 V2O3+O2+CaCO3![]() Ca(VO3)2+CO2 加入硫酸使
Ca(VO3)2+CO2 加入硫酸使![]() +2H+
+2H+![]() +H2O中c(
+H2O中c(![]() )降低,Ca(VO3)2溶解平衡Ca(VO3)2(s) Ca2+(aq)+
)降低,Ca(VO3)2溶解平衡Ca(VO3)2(s) Ca2+(aq)+![]() (aq)正向移动,Ca(VO3)2溶解 (VO2)2SO4 NH4VO3不溶于乙醇,减少损失 0.8 HVO3
(aq)正向移动,Ca(VO3)2溶解 (VO2)2SO4 NH4VO3不溶于乙醇,减少损失 0.8 HVO3
【解析】
钒钛磁铁矿高温煅烧得到铁水和钒渣,钒渣中的V2O3与CaCO3混合后在空气中焙烧时转化为Ca(VO3)2,根据元素守恒可知同时得到CO2;Ca(VO3)2悬浊液中存在沉淀溶解平衡Ca(VO3)2(s)Ca2+(aq)+![]() (aq)正向移动,加入硫酸使
(aq)正向移动,加入硫酸使![]() +2H+
+2H+![]() +H2O平衡正向移动,得到含
+H2O平衡正向移动,得到含![]() 的溶液,溶液中加入碳酸氢铵溶液得到NH4VO3沉淀,过滤洗涤干燥后高温煅烧得到V2O5。
的溶液,溶液中加入碳酸氢铵溶液得到NH4VO3沉淀,过滤洗涤干燥后高温煅烧得到V2O5。
(1)粉碎、加热、搅拌、适当提高硫酸浓度都可以提高浸取率;
(2)根据元素守恒可知该温室气体应为CO2,化学方程式为V2O3+O2+CaCO3![]() Ca(VO3)2+CO2;
Ca(VO3)2+CO2;
(3)根据题目信息可知,加入硫酸可使![]() +2H+
+2H+![]() +H2O平衡正向移动,c(
+H2O平衡正向移动,c(![]() )降低,Ca(VO3)2溶解平衡Ca(VO3)2(s)Ca2+(aq)+
)降低,Ca(VO3)2溶解平衡Ca(VO3)2(s)Ca2+(aq)+![]() (aq)正向移动,Ca(VO3)2溶解;浸出液中V元素存在形式为
(aq)正向移动,Ca(VO3)2溶解;浸出液中V元素存在形式为![]() ,溶液中的阴离子为硫酸根,所以含钒物质的化学式为(VO2)2SO4;
,溶液中的阴离子为硫酸根,所以含钒物质的化学式为(VO2)2SO4;
(4)根据题目信息可知NH4VO3不溶于乙醇,所以用乙醇洗涤可以减少溶解损耗;
(5)浸出液中c(![]() )=0.1molL-1,沉淀率达到98%时,溶液中c(
)=0.1molL-1,沉淀率达到98%时,溶液中c(![]() )=0.1molL-1×(1-98%)=0.002mol/L,则c(
)=0.1molL-1×(1-98%)=0.002mol/L,则c(![]() )=
)= =0.8 molL-1;
=0.8 molL-1;
(6)铵盐不稳定受热易分解,根据最终产物V2O5可知分解过程不是氧化还原过程,所以NH4VO3受热分解过程中会产生NH3,1.17gNH4VO3的物质的量为![]() =0.01mol,根据元素守恒可知加热分解过程可以产生0.01mol氨气,加热到200℃时,固体减少的质量为0.17g,刚好是0.01molNH3,所以该段发生的反应为NH4VO3
=0.01mol,根据元素守恒可知加热分解过程可以产生0.01mol氨气,加热到200℃时,固体减少的质量为0.17g,刚好是0.01molNH3,所以该段发生的反应为NH4VO3![]() NH3↑+HVO3,此时剩余的固体物质为HVO3。
NH3↑+HVO3,此时剩余的固体物质为HVO3。